题目内容
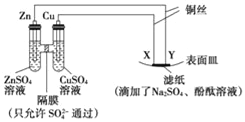
【题目】微生物电解法可用于处理工业废水,其工作原理如同所示,下列说法不正确的是

A. 左测电极反应式是2H2O+NH4+-6e-=NO2-+8H+
B. 在微生物作用下,废水中的NH4+最终转化为N2
C. a是电池的正极,b是电池的负极
D. 处理0.5 mol NH4+,经过溶液中电子的物质的量是3 mol
【答案】D
【解析】A.根据图知,连接a的电极上 NH4+失电子生成NO2-,发生氧化反应,为阳极,左测电极反应式是2H2O+NH4+-6e-=NO2-+8H+,A正确;B.连接b的电极上亚硝酸根离子得电子发生还原反应,右侧电极上生成氮气和水,即在微生物作用下,废水中的NH4+最终转化为N2,B正确;C. 根据以上分析可知a是电池的正极,b是电池的负极,C正确;D.左侧电极反应式为2H2O+NH4+-6e-=NO2-+8H+,根据方程式知,消耗1mol铵根离子转移6mol电子,但电子不能在溶液中定向移动,溶液中离子的定向移动形成回路,D错误;答案选D。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】实验室可用![]() 和
和![]() 为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
30℃时几种盐的溶解度/![]()
|
|
|
|
|
|
|
|
|
36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
制备纯碱的步骤如下:
①配制50![]() 约25%的粗食盐水溶液(密度近似为1
约25%的粗食盐水溶液(密度近似为1![]() )。
)。
②精制食盐水(粗食盐中含有少量![]() 、
、![]() 、
、![]() 等杂质),用盐酸将滤液的
等杂质),用盐酸将滤液的![]() 值调至7。
值调至7。
③加热食盐水,将溶液温度控制在30~35℃。
④在不断搅拌下,分次将研细的![]() 加入食盐水中,加完料后,继续保温、搅拌半小时。
加入食盐水中,加完料后,继续保温、搅拌半小时。
⑤静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是____________。
(2)步骤②中,![]() 是否需要除去?__________,理由是________________。
是否需要除去?__________,理由是________________。
(3)步骤④中所有操作的共同目的是__________________________。
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是___________________。