题目内容
下列叙述正确的是( )
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中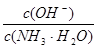 增大 增大 |
C
A中根据电荷守恒可知c(OH-)+2c(SO42-)=c(NH4+)+c(H+),所以当pH=7时,c(SO42-)<c(NH4+),A不正确。醋酸是弱酸,存在电离平衡,稀释促进电离。所以将浓度为c1的醋酸稀释10倍,则pH大于a+1,要达到a+1,则需要继续稀释,即c1>10c2,所以B不正确。C中醋酸一定是过量的,溶液显酸性,C正确。硫酸铵是抑制氨水电离的,因此选项D是错误的,应该是减小,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
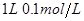 醋酸
醋酸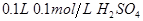 溶液
溶液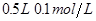 盐酸
盐酸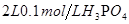 溶液
溶液
 H++A-,回答下列问题:
H++A-,回答下列问题: