题目内容
水杨酸是重要的精细化工原料,它的结构简式为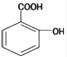 .水杨酸的芳香族同分异构体 ( )
.水杨酸的芳香族同分异构体 ( )
A.可能含有两个醛基 B.可能含有三个羟基
C.都能溶于氢氧化钠溶液 D.分子式都是C7H7O3
C

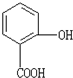
| A、分子式是C7H7O3 | B、可以与NaOH反应,但不能与Na2CO3反应 | C、能发生取代反应和加成反应 | D、它的同分异构体可以是酯类 |
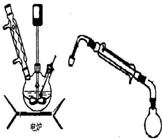
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
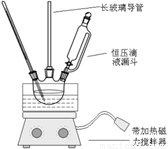
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)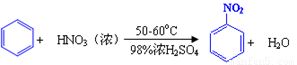
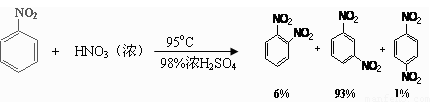
(2)可能用到的有关数据列表如下
|
物质 |
熔点/℃ |
沸点/℃ |
密度(20 ℃) / g·cm-3 |
溶解性 |
|
苯 |
5.5 |
80 |
0.88 |
微溶于水 |
|
硝基苯 |
5.7 |
210.9 |
1.205 |
难溶于水 |
|
1,3-二硝基苯 |
89 |
301 |
1.57 |
微溶于水 |
|
浓硝酸 |
|
83 |
1.4 |
易溶于水 |
|
浓硫酸 |
|
338 |
1.84 |
易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 。
(2)恒压滴液漏斗的优点是 。
(3)实验装置中长玻璃管可用 代替(填仪器名称)。
(4)反应结束后产品在液体的 层(填“上”或者“下”),分离混酸和产品的操作方法为 。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(6)为了得到更纯净的硝基苯,还须先向液体中加入 除去水,然后蒸馏,
 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途. 用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→H2N-NH2?H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途. 用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→H2N-NH2?H2O+NaCl+Na2CO3. (阿司匹林)。水杨酸具备下列条件的同分异构体有
(阿司匹林)。水杨酸具备下列条件的同分异构体有