题目内容
常温下,向物质的量浓度均为0.1mol·L-1的盐酸和氯化钙的混合溶液中逐滴加入0.1mol/L碳酸钠溶液至沉淀刚好完全。下图中关系正确的是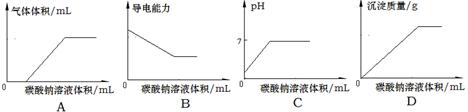
C
解析试题分析:向物质的量浓度均为0.1mol/L的盐酸和氯化钙的混合溶液中不断滴入0.1mol/L碳酸钠溶液,先发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,立即产生气体,开始不产生沉淀,溶液的pH值增大,溶液的导电能力降低;HCl反应完毕,然后发生反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,气体的体积一定,开始产生沉淀,溶液的pH不再变化,呈中性,但溶液的导电能力继续降低,A、向混合溶液中不断滴入0.1mol/L碳酸钠溶液,盐酸过量,立即产生二氧化碳气体,图象与实际不相符,故A错误;B、随碳酸钠溶液的加入,溶液的导电能力会降低,不会出现导电能力不变的情况,故B错误;C、溶液开始的pH=1,随碳酸钠加入,溶液pH增大,最后溶液呈中性,图象与实际相符合,故C正确;
D、开始不产生沉淀,HCl反应完毕,再生成沉淀,图象与实际不相符,故D错误;故选C。
考点:本题考查反应图象问题,难度中等,清楚发生的反应过程是解题的关键。

练习册系列答案
相关题目
下列无色透明溶液中离子能大量共存的是( )
| A.Na+、Cu2+ 、NO3-、Cl- | B.Na+、Zn2+、OH-、Br- |
| C.K +、SO42-、Cl-、Mg2+ | D.Ba2+ 、Na+ 、OH-、CO32- |
能在水溶液中大量共存的离子组是
| A.H+、Fe3+、ClO-、Cl- | B.H+、NH4+、Fe2+、NO3- |
| C.Ag+、K+、Cl-、SO42- | D.K+、AlO2-、Cl-、OH- |
下列反应的离子方程式不正确的是
| A.NaOH溶液与稀H2SO4反应:H++OH—=H2O |
| B.NaHCO3与NaOH两溶液反应:HCO3—+OH—=CO32—+H2O |
| C.金属钠与水反应:2Na+2H2O=2Na++2OH—+H2↑ |
| D.AlCl3溶液中滴加过量的氨水:Al3++4OH—=AlO2—+2H2O |
在酸性溶液中,能大量共存的离子组是
| A.K+、OH-、S042- | B.Cl-、N03-、Cu2+ |
| C.Al3+、C032-、Na+ | D.Ca2+、HC03-、NH4+ |
常温下,下列各组离子在指定的溶液中一定能大量共存的是
| A.加入铝产生H2的溶液:NO3-、NH4+、Ba2+、Cl-、Na+ |
| B.使酚酞变红的色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C.0.1 mol/L的FeCl3溶液:Ba2+、NO3-、Na+、Cu2+、I- |
| D.0.1 mol/L的NH4Cl溶液:K+、Na+、HCO3-、SO42- |
下列离子或物质组能大量共存,进行相关操作后出现的现象或结论叙述完全正确的一组是
| 选项 | 离子或物质 | 操作、现象或结论 |
| A | Na+、 K+、Cl—、SO42— | 通入 CO2后 c(Na+)+c(K+)=c(SO42-)+ c(Cl—) +c(CO32-)成立 |
| B | NH4+、Mg2+、Cl—、NO3— | 加入铝粉能产生氢气 |
| C | K+、Cr2O72—、CH3CH2OH、SO42— | 加入盐酸后溶液褪色 |
| D | SO2、O2、NO2 | 混合气体通入足量NaOH溶液后,可能会没有任何气体剩余 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A.无色透明的溶液中:MnO4-、SO42-、K+、Fe2+ |
| B.pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ |
| C.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| D.水电离产生的c(H+)=1×10-14mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2,溶液中离子浓度增大的是
| A.HCO3- | B.SO42- | C.SO32- | D.OH- |