题目内容
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 → HCO3-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- → CaCO3↓+ CO32-+ 2H2O
C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 → 2Fe3++6Cl-+2Br2
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-→ BaSO4↓+H2O
【答案】
B
【解析】
试题分析:A中还有沉淀生成,错误; C中正确的是表达是2Fe2++2Br-+2Cl2 → 2Fe3++4Cl-+Br2,错误; D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:两者物质的量之比为2:1,正确表达是2H++SO42-+Ba2++2OH-→ BaSO4↓+2H2O,错误;
考点:本题考查离子方程式的正误判断。

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )
A、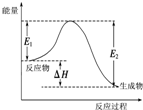 图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 | B、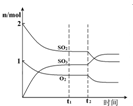 图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | C、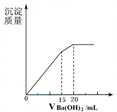 图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | D、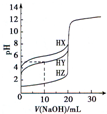 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图中曲线可确定HX的酸性最强 |
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方
案经老师批准后进行试验,实验现象记录如下表(实验方案4、5盐酸浓度因记
录表中数据模糊,分别用a、b表示):
请根据记录回答下列问题:
(1)该同学的实验目的为______;
(2)请比较a、b的大小关系(选择“>”、“<”、“=”填空):a______b
(3)完成实验方案3除需要烧杯、小刀、玻璃片、胶头滴管等外,还必须用到的一种仪器名称是______;
(4)请根据记录表填写实验现象序号对应的实验方案编号:
I______I I______III______IV______;
(5)请分别写出下列实验方案中各现象对应的离子方程式:
实验方案2:______
实验方案3:______
(6)该实验结论是______.
案经老师批准后进行试验,实验现象记录如下表(实验方案4、5盐酸浓度因记
录表中数据模糊,分别用a、b表示):
| 实验方案 | 实验现象 |
| 1,用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2,向新制的H2S饱和溶液中滴加新制的氯水 3,钠与滴有酚酞试液的冷水反应 4,镁条与amol/L的盐酸反应 5,铝条与bmol/L的盐酸反应 6,向AlCl3溶液中滴加NaOH溶液至过量 | I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 I I.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
(1)该同学的实验目的为______;
(2)请比较a、b的大小关系(选择“>”、“<”、“=”填空):a______b
(3)完成实验方案3除需要烧杯、小刀、玻璃片、胶头滴管等外,还必须用到的一种仪器名称是______;
(4)请根据记录表填写实验现象序号对应的实验方案编号:
I______I I______III______IV______;
(5)请分别写出下列实验方案中各现象对应的离子方程式:
实验方案2:______
实验方案3:______
(6)该实验结论是______.
