题目内容
硫酸和盐酸的混合溶液20mL,在这溶液中加入0.025 mol/L氢氧化钡溶液时生成硫酸钡的量和溶液的pH值如图所示。
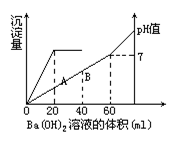
试计算:
(1)最初溶液中硫酸和盐酸的物质的量浓度
(2)A、B两点溶液的 pH值(溶液混合时体积变化忽略不计,pH值可以保留对数形式)。

试计算:
(1)最初溶液中硫酸和盐酸的物质的量浓度
(2)A、B两点溶液的 pH值(溶液混合时体积变化忽略不计,pH值可以保留对数形式)。
(1)[H2SO4]="0.025" mol/L,[HCl]= 0.10 mol/L
(2)pHA="2-1g5" pHB=2-1g1.67
(2)pHA="2-1g5" pHB=2-1g1.67
如图中曲线表明:跟硫酸反应生成硫酸钡沉淀消耗Ba(OH)2溶液20mL;而跟硫酸,盐酸进行中和反应,消耗Ba(OH)2溶液60mL。
(1)H2SO4+Ba(OH2)=BaSO4↓+2H2O ①
2HCl+Ba(OH)2=BaCl2+2H2O ②
反应①中,消耗Ba(OH)2的物质的量=0.025×0.020=5.0×10-4mol,
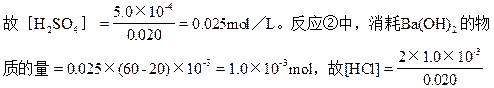
="0.10" mol/L。
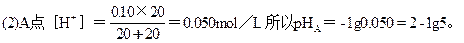
B点H2SO4已被中和完全,部分HCl被中和。
已被中和的HCl的物质的量=0.025×(40-20)×10-3×2=1.0×10-3mol
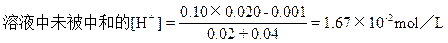
所以,pHB=-1g1.67×10-2=2-1g1.67。
(1)H2SO4+Ba(OH2)=BaSO4↓+2H2O ①
2HCl+Ba(OH)2=BaCl2+2H2O ②
反应①中,消耗Ba(OH)2的物质的量=0.025×0.020=5.0×10-4mol,
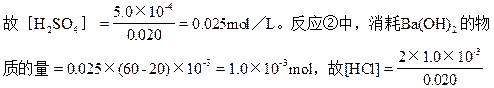
="0.10" mol/L。
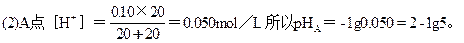
B点H2SO4已被中和完全,部分HCl被中和。
已被中和的HCl的物质的量=0.025×(40-20)×10-3×2=1.0×10-3mol
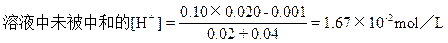
所以,pHB=-1g1.67×10-2=2-1g1.67。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 )=2.0×10-6 mol·L-1,c(Cl-)=6.0×10-6 mol·L-1,c(Na+)=3.0×10-6 mol·L-1,c(
)=2.0×10-6 mol·L-1,c(Cl-)=6.0×10-6 mol·L-1,c(Na+)=3.0×10-6 mol·L-1,c( )=2.3×10-5 mol·L-1,c(
)=2.3×10-5 mol·L-1,c( )=3.8×10-5 mol·L-1,则此次雨水的pH约为( )
)=3.8×10-5 mol·L-1,则此次雨水的pH约为( )