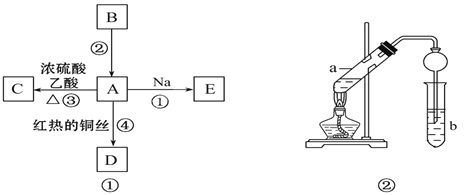
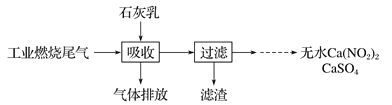
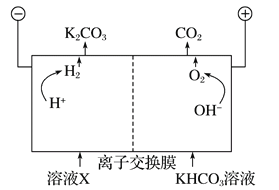
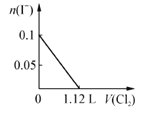
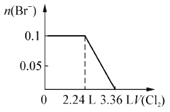
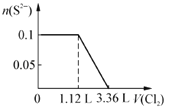
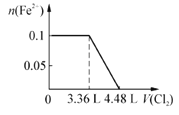
题目内容
【题目】【化学——选修3:物质结构与性质】丁二酮肟![]() 是检验Ni2+的灵敏试剂。
是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为___________ 。丁二酮肟分子中C原子轨道杂类型为 ____________,1mol丁二酮肟分子所含![]() 键的数目为 ____________,分子中各原子的电负性由大到小的顺序为______________。
键的数目为 ____________,分子中各原子的电负性由大到小的顺序为______________。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。
①Ni(CO)4固态时属于 __________晶体(填晶体类型)。
②与CO互为等电子体的阴离子为 ________________(填化学式)。
(3)Ni2+与Mg2+、O2—形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 ____________。
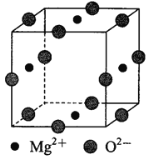
【答案】(1)[Ar]3d8 (2分) sp3和sp2 (2分) 15mol(或15×6.02×1023)(2分)
O〉N〉C〉H (2分) (2)①分子(2分) ②CN- (2分) (3)Mg2NiO3(3分)
【解析】
试题分析:(1)Ni是28号元素,根据原子核外电子排布规律可知,Ni2+的基态核外电子排布式为[Ar]3d8;甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化,已知丁二酮肟的结构式为![]() ,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;非金属性越强,电负性越大,则电负性大小顺序是O〉N〉C〉H;
,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;非金属性越强,电负性越大,则电负性大小顺序是O〉N〉C〉H;
(2)①分子晶体的熔沸点较低,四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂,所以该物质为分子晶体;
②原子数和价电子数分别相等的是等电子体,由第二周期主族元素组成的且与CO互为等电子体的阴离子为CN-;
(3)氧离子位于该晶胞的棱上,氧离子个数=1/4×12=3,所以该晶胞含有3个氧离子;镁离子处在面上,镁离子个数=1/2×4=2,该晶胞中含有2个镁离子,根据化学式中元素化合价代数和为零,该晶胞中含有1个Ni,所以该晶胞的化学式为Mg2NiO3。