题目内容
用中和滴定法测定某烧碱的纯度。
(1)配制待测液
将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要仪器有________________________________________________________________________
________________________________________________________________________。
(2)滴定
①盛装0.200 mol·L-1盐酸标准液应该用__________式滴定管,盛装前对滴定管的要求是:________________________________________________________________________
________________________________________________________________________。
②滴定时,应先向锥形瓶中加________滴__________作指示剂;滴定过程中两眼应注视________________________,当_______________________________时为滴定终点。
③有关数据记录如下:
|
滴定序号 |
待测液体体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
① |
20.00 |
0.50 |
20.70 |
|
② |
20.00 |
6.00 |
26.00 |
(3)纯度计算
NaOH溶液的浓度为__________mol·L-1,烧碱样品的纯度为__________。
(4)对几种假定情况的讨论
①若用蒸馏水冲洗锥形瓶,则会使测定结果______;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果__________;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________。(以上均填“偏低”、“偏高”或“无影响”)
(1)烧杯、玻璃棒、200 mL容量瓶、胶头滴管
(2)①酸 用蒸馏水洗净后,还需用0.200 mol·L-1盐酸标准溶液润洗2~3次
②2~3 甲基橙 锥形瓶内溶液颜色变化 滴入最后一滴,溶液的颜色突变为橙色且半分钟内不褪色
(3)0.201 94.6%
(4)①无影响 ②偏高 ③偏低 ④偏低
【解析】
试题分析:(1)配制物质的量浓度溶液时需要的主要仪器是烧杯、玻璃棒、200 mL容量瓶、胶头滴管。
(2)①盐酸是强酸,应该用酸式滴定管盛放。滴定管用蒸馏水洗净后,还需用0.200 mol/L盐酸标准溶液润洗2~3次。
②滴定时,应先向锥形瓶中加2~3滴甲基橙作指示剂;滴定过程中两眼应注视锥形瓶内溶液颜色变化,当滴入最后一滴,溶液的颜色突变为橙色且半分钟内不褪色时为滴定终点。
(3)两次实验中消耗盐酸的体积分别是20.20ml和20.00ml,则消耗盐酸的平均值是20.10ml,所以氢氧化钠溶液的浓度是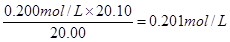 。所以纯度是
。所以纯度是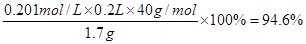 。
。
(4)①若用蒸馏水冲洗锥形瓶,则不会影响测定结果。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则消耗盐酸的体积增加,所以会使测定结果偏高。
③若刚见到指示剂局部的颜色有变化就停止滴定,这说明反应还未达到滴定终点,所以会使测定结果偏低。
④读数时,若滴定前仰视,读数偏大。滴定后俯视,读数偏小,所以消耗盐酸的以及减少,则会使测定结果偏低。
考点:考查物质的量浓度配制、酸碱中和滴定基本实验操作、计算以及误差分析
点评:这是一道考查学生的溶液配制、中和滴定操作等综合能力的题目。解此题时应以操作为主线,以c(待测)=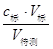 为前提,联想每步操作中所用仪器及操作不当所引起的误差,有利于培养学生的逻辑推理能力和规范严谨的实验设计、动手操作能力,提升学生的学科素养,激发学生的学习兴趣。
为前提,联想每步操作中所用仪器及操作不当所引起的误差,有利于培养学生的逻辑推理能力和规范严谨的实验设计、动手操作能力,提升学生的学科素养,激发学生的学习兴趣。

(10分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质(不与盐酸反应)的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视 ;
在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(10分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质(不与盐酸反应)的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视 ;
在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
|
滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
|
滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在______(填编号字母)称量.
A.小烧杯中
B.洁净纸片上
C.托盘上
(2)滴定时,用0.2000mol?L-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视______,在铁架台上垫一张白纸,其目的是______
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是______mol?L-,烧碱样品的纯度是______
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______.