题目内容
2.下列说法中,正确的是(NA表示阿伏加德罗常数)( )| A. | 18g水在标准状况下的体积约为22.4L | |
| B. | 在标准状况下,22.4L氮气中含有NA个氮原子 | |
| C. | 17gNH3中含有的原子总数目为4NA | |
| D. | 80gNaOH溶解在1L水中,得到溶液的物质的量浓度为2mol/L |
分析 A、标况下水为液态;
B、标况下,22.4L氮气的物质的量为1mol;
C、求出氨气的物质的量,然后根据氨气为4原子分子来分析;
D、当氢氧化钠溶于1L水后,溶于体积大于1L.
解答 解:A、标况下水为液态,故18g水的物质的量为1mol,但在标况下的体积小于22.4L,故A错误;
B、标况下,22.4L氮气的物质的量为1mol,而氮气为双原子分子,故1mol氮气中含2mol单原子即2NA个,故B错误;
C、17g氨气的物质的量为1mol,而氨气为4原子分子,故1mol氨气中含4mol氢原子即4NA个,故C正确;
D、当氢氧化钠溶于1L水后,溶于体积大于1L,故溶液的浓度小于2mol/L,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
12.燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,则表示乙醇燃烧热的热化学方程式书写正确的是( )
| A. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1);△H=-Q kJ/mol | |
| B. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1);△H=-$\frac{Q}{2}$ kJ/mol | |
| C. | $\frac{1}{2}$ C2H5OH(1)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(1);△H=-Q kJ/mol | |
| D. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1);△H=-2Q kJ/mol |
13.下列物质加热后不能得到相应氧化物的是( )
| A. | NaOH | B. | Al(OH)3 | C. | Fe(OH)3 | D. | Cu(OH)2 |
10.A(g)+B(g)?C(g)+D(g) 反应过程中的能量(单位为kJ•mol-1)变化如图所示,下列说法正确的是( )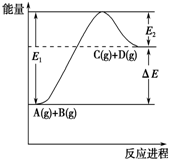

| A. | 该反应是放热反应 | |
| B. | C(g)+D(g )?A(g)+B(g)△H═△E KJ•mol-1 | |
| C. | 加入催化剂后,反应加快,E1、E2和△E都减小 | |
| D. | E1表示正反应的活化能,升高温度,E1不变 |
7.中华语言博大精深,下列词语中,其含意是物理变化的是( )
| A. | 蜡炬成灰 | B. | 曾青得铁 | C. | 百炼成钢 | D. | 大浪淘沙 |
14.在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(g)+2B(g)?C(g)+D(g)已达到平衡状态的是( )
| A. | 混合气体的密度 | B. | 混合气体的总物质的量 | ||
| C. | 混合气体的压强 | D. | 混合气体的总体积 |
11.下列物质中,属于电解质的是( )
| A. | CO2 | B. | 盐酸 | C. | CaCO3 | D. | NaOH溶液 |
12.实验室里需用500mL 0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,有关以下操作正确的是( )
| A. | 称取8.0 g硫酸铜固体,加入500 mL水 | |
| B. | 配制好的硫酸铜溶液应转移到细口试剂瓶中,并贴上标签 | |
| C. | 滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体吸走 | |
| D. | 定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线 |