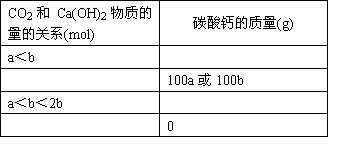
题目内容
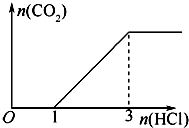 将a mol CO2通入1L 3mol/L的NaOH溶液中,充分反应后,再逐滴加入稀盐酸,反应如图所示,则a=
将a mol CO2通入1L 3mol/L的NaOH溶液中,充分反应后,再逐滴加入稀盐酸,反应如图所示,则a=分析:由图可知,0~1mol没有气体生成,从1mol开始加盐酸生成二氧化碳气体,共消耗盐酸3mol-1mol=2mol,则1L 3mol/L的NaOH溶液中通入a molCO2反应后溶液中的溶质为Na2CO3、NaHCO3,且二者的量相同,然后根据钠守恒求出两者的物质的量,最后根据碳守恒求出二氧化碳气体的物质的量;
解答:解:0~1mol没有气体生成,从1mol开始加盐酸生成二氧化碳气体,共消耗盐酸3mol-1mol=2mol,两个过程消耗的酸的体积比为1:2,则NaOH溶液通入一定量CO2反应后溶液中的溶质为等物质的量的Na2CO3、NaHCO3,设Na2CO3、NaHCO3,的物质的量都为x,据钠守恒有:2x+x=3mol,解得x=1mol,由碳原子守恒可知二氧化碳的物质的量为1mol+1mol=2mol,即参加反应的CO2气体的物质的量为2mol;
故答案为:2;n(Na2CO3):n(NaHCO3)=1:1;
故答案为:2;n(Na2CO3):n(NaHCO3)=1:1;
点评:本题较复杂,考查学生利用图象来分析碱与二氧化碳反应的产物,明确图象中盐酸的用量关系是解答的关键,并注意利用原子守恒的方法来进行计算.

练习册系列答案
相关题目
 已知298K时:
已知298K时: