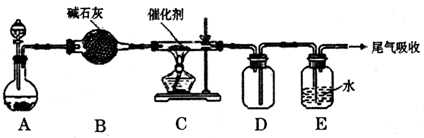
题目内容
将0.18molMnO2与过量12mol/L的浓盐酸反应,将60mL12mol/L的浓盐酸与足量的MnO2反应,两者产生的Cl2相比( )
| A.一样多 | B.前者较后者多 |
| C.后者较前者多 | D.无法比较 |
n(MnO2)=0.18mol,依据化学方程式 MnO2+4HCl
MnCl2+Cl2↑+H2O,二氧化锰全部反应生成氯气物质的量为0.18mol;
将60mL12mol/L的浓盐酸与足量的MnO2反应,n(HCl)=0.06L×12mol?L-1=0.72mol,依据化学方程式 MnO2+4HCl
MnCl2+Cl2↑+H2O,当0.72molHCl完全反应时可生成0.18molCl2,但随着反应的进行,盐酸的浓度逐渐降低,稀盐酸的还原性较弱,与二氧化锰不反应,则生成的氯气的物质的量小于0.18mol,所以前者生成氯气较多.
故选B.
| ||
将60mL12mol/L的浓盐酸与足量的MnO2反应,n(HCl)=0.06L×12mol?L-1=0.72mol,依据化学方程式 MnO2+4HCl
| ||
故选B.

练习册系列答案
相关题目