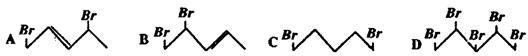题目内容
有两种气态不饱和烃的混合物1体积,完全燃烧后可得3.8体积CO2和3.6体积水蒸气(气体体积均在相同条件下测定),则这两种烃是……( )
| A.C2H4、C4H6 | B.C2H2、C4H8 | C.C3H4、C4H8 | D.C3H4、C3H6 |
C
n混:nC:nH=V混:VCO2:VH2O×2=1:3.8:7.2,该混合烃的平均组成为C3.8H7.2。因为选项(A)中各组分分子中氢原子数分别为4和6,选项(D)中各组分分子中碳原子数都为3,(A)和(D)中混合烃的平均组成都不可能为C3.8H7.2,所以(A)、(D)都不是正确选项,符合平均组成的选项为(B)和(C),如果据此得出结论,认为答案就是(B)和(C),那就错了,还要根据“差量”3.8-3.6=0.2的含义进行分析。
选项(B)和(C)都是丁烯(C4H8)与炔烃(CnH2n-2)的组合,根据各组分的分子组成及两个关系式C--CO2、2H--H2O,可知仁义量烯烃燃烧后,生成的CO2和水蒸气在相同条件下体积都是相同的,即不存在体积差。而每燃烧1体积的炔烃,生成CO2比水蒸气多1体积,所以“差量”0.2等于炔烃的体积数,则丁烯为1-0.2=0.8。设炔烃分子中碳原子数为n,则有0.2n+0.8×4=3.8,解得n=3,故本题的正确选项为(C).
[评注]从上述解法可知,确定混合烃的组成时,虽然根据题知条件求出平均组成,如果只凭平均组成就下结论,就会出现失误。因为平均组成只是相关量取值范围的一个界限,而能满足某一平均组成的混合烃常常会有多种组合,这些组合是否都符合题给条件,还要进行分析。本题中生成的CO2和H2O(气)的体积差(或物质的量差)却直接决定于混合烃各组分的相对含量、种类和组成。分析“差量”和相关量的关系并进行计算,即可求出各组份的量,从而确定组成,得出正确结论。所以在解上述题时,用“平均值法”一般只能确定符合题意的范围,最后还要靠“差量分析法”作出正确的结论
选项(B)和(C)都是丁烯(C4H8)与炔烃(CnH2n-2)的组合,根据各组分的分子组成及两个关系式C--CO2、2H--H2O,可知仁义量烯烃燃烧后,生成的CO2和水蒸气在相同条件下体积都是相同的,即不存在体积差。而每燃烧1体积的炔烃,生成CO2比水蒸气多1体积,所以“差量”0.2等于炔烃的体积数,则丁烯为1-0.2=0.8。设炔烃分子中碳原子数为n,则有0.2n+0.8×4=3.8,解得n=3,故本题的正确选项为(C).
[评注]从上述解法可知,确定混合烃的组成时,虽然根据题知条件求出平均组成,如果只凭平均组成就下结论,就会出现失误。因为平均组成只是相关量取值范围的一个界限,而能满足某一平均组成的混合烃常常会有多种组合,这些组合是否都符合题给条件,还要进行分析。本题中生成的CO2和H2O(气)的体积差(或物质的量差)却直接决定于混合烃各组分的相对含量、种类和组成。分析“差量”和相关量的关系并进行计算,即可求出各组份的量,从而确定组成,得出正确结论。所以在解上述题时,用“平均值法”一般只能确定符合题意的范围,最后还要靠“差量分析法”作出正确的结论

练习册系列答案
相关题目
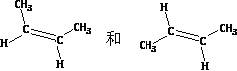 互为同分异构体)
互为同分异构体)
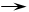 Ca(OH) 2+C2H2↑
Ca(OH) 2+C2H2↑ 
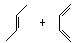 ─→_______
─→_______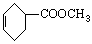
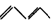 与Br2起加成反应,生成的产物可以是( )
与Br2起加成反应,生成的产物可以是( )