题目内容
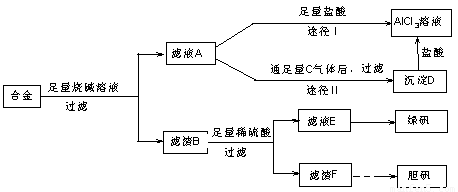
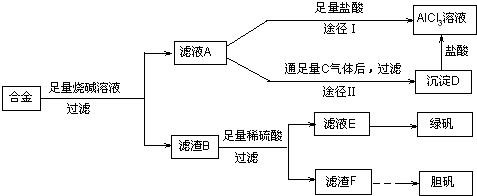
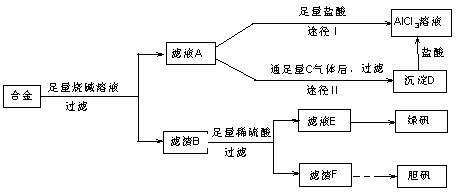
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如图1-3-22:
图1-3-22
试完成下列各题:
(1)过滤用的器材已有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是,理由是________________。
(3)从滤液E中得到绿矾晶体的实验操作是__________________________________________。
(4)写出用滤渣F制备胆矾晶体的化学方程式________________________________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理?________,理由是________________________________。
解析:(1)联想过滤装置常用仪器,可知需补充的玻璃仪器有漏斗和玻璃棒。(2)由题意知滤液A为NaAlO2溶液,若按途径Ⅰ,则发生反应NaAlO2+4HCl====NaCl+AlCl3+2H2O,所得AlCl3溶液中会含有大量NaCl杂质,而按途径Ⅱ时,NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3,过滤得纯净Al(OH)3,Al(OH)3+3HCl====AlCl3+3H2O,所得AlCl3不含杂质,故合理的途径为Ⅱ。(3)滤渣B为Fe、Cu混合物,与稀H2SO4反应后,所得滤液为FeSO4,滤渣为Cu。将滤液蒸发浓缩后冷却结晶,可得绿矾。(4)由Cu制备胆矾一般经过以下几个反应:2Cu+O2![]() 2CuO,CuO+H2SO4====CuSO4+H2O,CuSO4+5H2O====CuSO4·5H2O。(5)若按该同学的方案需经如下的转化:
2CuO,CuO+H2SO4====CuSO4+H2O,CuSO4+5H2O====CuSO4·5H2O。(5)若按该同学的方案需经如下的转化:

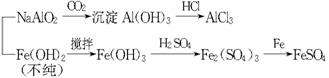
显然操作步骤多,消耗试剂量更大,所需时间过长。
答案:(1)漏斗、玻璃棒
(2)途径Ⅱ 因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入C(CO2)气体,得D〔Al(OH)3〕沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径Ⅱ更合理
(3)蒸发浓缩、冷却结晶
(4)2Cu+O2![]() 2CuO
2CuO
CuO+H2SO4====CuSO4+H2O
CuSO4+5H2O====CuSO4·5H2O(合并后面两个化学方程式,正确也可)
(5)不合理 该方案不符合实验方案设计的简约性原则,即操作步骤多、消耗试剂量更大、时间长

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案

 。
。