题目内容
1.92g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜完全反应时,共生成标准状况下的气体1.12L(只含NO和NO2).则反应消耗的HNO3的物质的量为
- A.0.06mol
- B.0.08mol
- C.0.11mol
- D.0.12mol
C
分析:n(Cu)= =0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算.
=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算.
解答:n(Cu)= =0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,
=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,
且n(NO)+n(NO2)=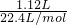 =0.05mol,
=0.05mol,
则根据N元素守恒可知共消耗硝酸的物质的量为:2×0.03mol+0.05mol=0.11mol,
故选C.
点评:本题考查硝酸的性质,注意根据反应产物结合质量守恒定律解答该题,题目难度不大.
分析:n(Cu)=
 =0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算.
=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算.解答:n(Cu)=
 =0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,
=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,且n(NO)+n(NO2)=
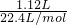 =0.05mol,
=0.05mol,则根据N元素守恒可知共消耗硝酸的物质的量为:2×0.03mol+0.05mol=0.11mol,
故选C.
点评:本题考查硝酸的性质,注意根据反应产物结合质量守恒定律解答该题,题目难度不大.

练习册系列答案
相关题目