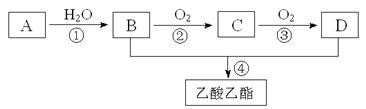
题目内容
【题目】雾霾严重影响人们的生活和健康,汽车尾气的大量排放是造成雾霾天气的重要原因之一。己知汽车尾气排放时容易发生以下反应:
①CO(g) +1/2 O2(g)![]() CO2(g) △H1=a kJ·mol-1
CO2(g) △H1=a kJ·mol-1
②2NO(g) +O2(g)![]() 2NO2(g) △H2=b kJ·mol-1
2NO2(g) △H2=b kJ·mol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=c kJ·mol-1
2NO(g) △H3=c kJ·mol-1
④2CO(g) +2NO(g)![]() N2(g)+2CO2(g) △H4
N2(g)+2CO2(g) △H4
请回答下列问题:
(1)写出反应①的平衡常数表达式K=___________________。
(2)下列情况能说明反应③已达平衡状态的是______________(填编号)。
A.在恒温恒容的容器中,混合气体的密度保持不变
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.在恒温恒压的容器中,NO的体积分数保持不变
D.单位时间内生成1mol NO2的同时消耗了lmol NO
(3)根据上述反应,确定反应④中△H4=__________kJ·mol-1
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。试分析实际化工生产中不采用高压的原因_________________________________________。
(5)其他条件不变时,探究反应④中平衡时CO2的体积分数与反应物中起始n(NO)/n(CO)的比值的关系,得到如图2所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是________________。

(6)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图3所示。其中b极上生成乙烯的电极反应式为___________________________。

【答案】 c(CO2)/[c(CO)·c1/2(O2) ] B、C (2a-c) 较低压强时,NO的转化率已经很高,增大压强,成本增加 Z>Y>X 2CO2+12H++12e-=C2H4+4H2O
【解析】(1)反应CO(g) +1/2 O2(g)![]() CO2(g)的平衡常数表达式K=
CO2(g)的平衡常数表达式K=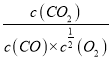 ;
;
(2)A.密度=![]() ,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故A错误;B.因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故B正确;C.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故C正确;D.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故D错误;故答案为BC;
,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故A错误;B.因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故B正确;C.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故C正确;D.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故D错误;故答案为BC;
(3)已知:①CO(g) +1/2 O2(g)![]() CO2(g) △H1=a kJ·mol-1,③N2(g)+O2(g)
CO2(g) △H1=a kJ·mol-1,③N2(g)+O2(g)![]() 2NO(g) △H3=c kJ·mol-1,根据盖斯定律,反应①×2-③即得,确定反应④2CO(g)+2NO(g)
2NO(g) △H3=c kJ·mol-1,根据盖斯定律,反应①×2-③即得,确定反应④2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H4=(2a-c)kJ/mol;
N2(g)+2CO2(g)△H4=(2a-c)kJ/mol;
(4)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大;
(5)温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X;
(6)电解时,二氧化碳在b极上发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O。

 阅读快车系列答案
阅读快车系列答案