题目内容
某金属若干克,其原子核外共有2mol电子,核内共有1.204×1024个中子;同质量的该金属跟足量稀盐酸反应,有0.2mol电子发生转移,生成6.02×1022个阳离子,试回答:
(1)该金属元素的原子符号为 ,摩尔质量为 。
(2)原子核的组成中,中子有 个,质子有 个。
【答案】
(1)Ca,40g·mol-1 (2)20 20
【解析】
试题分析:由题意知生成6.02×1022个阳离子,说明该离子的物质的量是0.1mol。因为生成0.1mol的金属阳离子需转移0.2mol电子,所以在该金属在反应中失去2个电子。由于相同质量的金属含有2mol电子,因此1mol该金属中含有的电子是20mol,因此质子数是20,是Ca元素;而中子数是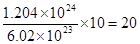 ,所以该元素的质量数是40,则摩尔质量是40g/mol。
,所以该元素的质量数是40,则摩尔质量是40g/mol。
考点:考查元素的推断、原子的组成的有关计算
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目