题目内容
18.(6分)(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的是_________________________。
① 联氨(N2H4)是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式 。
① 联氨(N2H4)是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式 。
(6分)(1)⑤⑥⑦⑧(对二个得1分,错、漏选1个扣1分)(2分)
(2)①N2H4+H2O NH2NH3+(或N2H5+)+ OH-(2分)
NH2NH3+(或N2H5+)+ OH-(2分)
②CO (NH2)2+ NaClO+ 2NaOH =(高锰酸钾催化剂) N2H4+NaCl+Na2CO3 +H2O(高锰酸钾催化剂,不写扣一分)(2分)
(2)①N2H4+H2O
 NH2NH3+(或N2H5+)+ OH-(2分)
NH2NH3+(或N2H5+)+ OH-(2分)②CO (NH2)2+ NaClO+ 2NaOH =(高锰酸钾催化剂) N2H4+NaCl+Na2CO3 +H2O(高锰酸钾催化剂,不写扣一分)(2分)
试题分析:(1)①④中不反应,②③中最终得到碳酸氢钙沉淀。⑤⑥⑦⑧分别得到碳酸氢钠沉淀、氢氧化铝沉淀、碳酸氢钠沉淀、硅酸沉淀,因此答案选⑤⑥⑦⑧。
(2)①溶于水显碱性,其原理与氨相似,所以溶于水反应的方程式是
N2H4+H2O
 NH2NH3+(或N2H5+)+ OH-。
NH2NH3+(或N2H5+)+ OH-。②根据原子守恒可知,另一种钠盐是氯化钠,所以反应的化学方程式是
CO (NH2)2+ NaClO+ 2NaOH
 N2H4+NaCl+Na2CO3 +H2O。
N2H4+NaCl+Na2CO3 +H2O。点评:在书写方程式时应该满足几个守恒关系,即原子守恒、电荷守恒以及电子的得失守恒等。

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
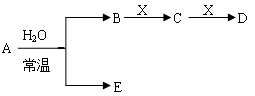
 +Xn
+Xn ——X单质
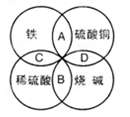
——X单质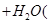 未配平); (乙
未配平); (乙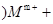 mOH-===M(OH)m
mOH-===M(OH)m
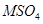 溶液一定能得到
溶液一定能得到 与足量氢氧化钠溶液反应一定生成M(OH)m
与足量氢氧化钠溶液反应一定生成M(OH)m