题目内容
下列离子方程式正确的是
Ca2++ +2OH-====CaCO3↓+
+2OH-====CaCO3↓+ +2H2O
+2H2O
| A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+====Ca2++2H2O |
B.用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl- |
| D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液: |
 +2OH-====CaCO3↓+
+2OH-====CaCO3↓+ +2H2O
+2H2OD
A:Ca(OH)2以澄清石灰水形式存在时,应拆为离子:OH—+H+=H2O
B:镁离子最终以沉淀形式存在:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
C.溴离子也应该被氧化:2Fe2++4Br—+3Cl2====2Fe3++2Br2+6Cl-
D:正确
故答案为D
B:镁离子最终以沉淀形式存在:Mg2++2Cl-+2H2O
 Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑C.溴离子也应该被氧化:2Fe2++4Br—+3Cl2====2Fe3++2Br2+6Cl-
D:正确
故答案为D

练习册系列答案
相关题目
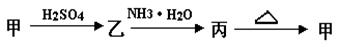
 丙转化的化学方程式 :_______________________________ .
丙转化的化学方程式 :_______________________________ . Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O H2S+2OH-
H2S+2OH- CH3COOH + OH—
CH3COOH + OH—