题目内容
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
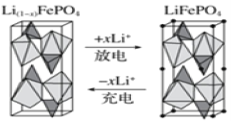
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。
【答案】K1·K2·K3 25% 不变 正向 不变 LiFePO4-xe-=Li(1-x)FePO4+xLi+
【解析】
(1)由反应I+反应II+反应III可得C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),由故其平衡常数K= K1·K2·K3,
CaCO3(s)+2H2(g),由故其平衡常数K= K1·K2·K3,
故答案为:K1·K2·K3;
(2)恒温恒压下,气体物质的量之比等于压强之比,
 ,
,
则![]() ,解得x=0.25,因此平衡时水蒸气的转化率为
,解得x=0.25,因此平衡时水蒸气的转化率为![]() =25%;碳为固体,增加其物质的量,对平衡无影响,因此对于水蒸气的转化率无影响,
=25%;碳为固体,增加其物质的量,对平衡无影响,因此对于水蒸气的转化率无影响,
故答案为:25%;不变;
(3)CaO(s)+CO2(g)![]() CaCO3(s)中,只有CO2一种气体,增加CO2浓度,平衡将向着气体体积减小的方向移动,即平衡正向移动;因K3=c(CO2),温度不变的情况下,平衡时CO2浓度不变,
CaCO3(s)中,只有CO2一种气体,增加CO2浓度,平衡将向着气体体积减小的方向移动,即平衡正向移动;因K3=c(CO2),温度不变的情况下,平衡时CO2浓度不变,
故答案为:正向;不变;
(4)由图可知,充电时LiFeO4失去电子,生成Li+,故充电时阳极电极反应式为:![]() ,
,
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有一无色透明溶液,欲确定是否含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,取该溶液的实验如下:
,取该溶液的实验如下:
实验步骤 | 实验现象 |
| 溶液变红色 |
| 有无色气体产生,气体遇空气可以变成红棕色 |
| 有白色沉淀生成 |
| 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是![]()
A.根据实验![]() 可以确定溶液中不含有
可以确定溶液中不含有![]() 和
和![]() ,因为这二个离子相对应的酸为弱酸
,因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;溶液中肯定不存在的离子是:
;溶液中肯定不存在的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
C.为进一步确定其它离子,应该补充焰色反应的实验来检验![]() 就可以
就可以
D.通过实验![]() 和
和![]() 就可以确定溶液中一定含有
就可以确定溶液中一定含有![]() ,一定不含有
,一定不含有![]() 、
、![]() 、
、![]() ,所以实验步骤
,所以实验步骤![]() 的设计是错误的
的设计是错误的
【题目】乳酸亚铁晶体{CH3CH(OH)COO]2Fe·3H2O}是一种很好的食品铁强化剂,易溶于水,广泛应用于乳制品、营养液等,吸收效果比无机铁好,可由乳酸与FeCO3反应制得:2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑
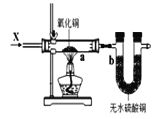
Ⅰ.制备碳酸亚铁(FeCO3):装置如图所示。

(1)仪器C的名称是______。
(2)清洗仪器,检查装置气密性,A中加入 盐酸,B中加入铁粉,C中加入NH4HCO3溶液。为顺利达成实验目的,上述装置中活塞的打开和关闭顺序为:关闭活塞_____,打开活塞_____,装置B中可观察到的现象是_____,当加入足量盐酸后,关闭活塞1,反应一段时间后,关闭活塞_____,打开活塞_____。C中发生的反应的离子方程式为_____。
Ⅱ. 制备乳酸亚铁晶体:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是_____。从所得溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气低温蒸发,冷却结晶、过滤、洗涤、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其原因可能是_____。
(5)经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.76g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00 mL,用0.100mol/LCe(SO4)2标准溶液滴定至终点,记录数据如表所示。
滴定次数 | 0.100mol/LCe(SO4)2标准溶液/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.65 |
2 | 0.12 | 22.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为______(以质量分数表示,保留3位有效数字)。