题目内容
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
D
解析试题分析:A与E同主族且能形成离子化合物EA,说明E和A一种是金属元素,一种是非金属元素,故为H和Na,根据单质F是一种重要的半导体材料得F为硅,B和F同主族,故B为碳,D的核电荷数是B的最外层电子数2倍,故D为氧,根据原子序数依次增大得C为氮;A、H、N、O可以形成离子化合物NH4NO3,故A正确;B、硅和氧形成的二氧化硅熔点高,但可以和HF反应,故B正确;C、列出他们在元素周期表中的位置,根据同周期和同主族的递变规律可得C正确;D、D为氧,没有最高价氧化物,D错误;故选D。
考点:元素的推断、元素周期律。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案下列叙述错误的是( )
| A.13C和14C属于同一种元素,它们互为同位素 |
| B.1H和2H是不同的核素,它们的质子数相等 |
| C.14C和14N的质量数相等,它们的中子数不等 |
| D.6Li和7Li的电子数相等,中子数也相等 |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,其中X原子最外层电子数是其电子层数的2倍。下列说法正确的是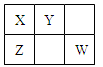
| A.四种元素的原子半径大小rY>rW>rX>rZ |
| B.元素X的含氧酸只有一种,元素Y则有两种 |
| C.元素Z的气态氢化物的稳定性比元素Y的强 |
| D.元素Y和W的氧化物是导致酸雨的主要原因 |
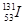 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中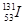 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关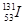 的叙述中错误的是( )
的叙述中错误的是( )
A.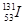 的化学性质与 的化学性质与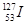 相同 相同 | B.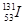 的原子序数为53 的原子序数为53 |
C.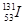 的原子核外电子数为78 的原子核外电子数为78 | D.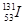 的原子核内中子数多于质子数 的原子核内中子数多于质子数 |
若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于
| A.ⅢA族 | B.ⅢB族 | C.ⅠB族 | D.ⅠA族 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.气态氢化物的热稳定性:H2T>H2R
C.M与T形成的化合物能溶于氨水溶液
D.相同条件下,单质与同浓度稀盐酸反应的速率:M>L
Se是人体必需微量元素,下列有关 Se和
Se和 Se的说法正确的是
Se的说法正确的是
A. Se 和 Se 和 Se所含电子数不同 Se所含电子数不同 | B. Se和 Se和  Se是两种不同的核素 Se是两种不同的核素 |
C. Se和 Se和  Se 分别含有44和46个质子 Se 分别含有44和46个质子 | D. Se和 Se和  Se都含有34个中子 Se都含有34个中子 |
以下是1-18号元素某性质的递变规律,Y轴代表的是 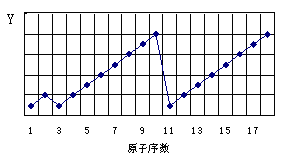
| A.原子半径 | B.金属性 | C.非金属性 | D.最外层电子数 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
| A.W、M的某种单质可作为水处理中的消毒剂 |
| B.电解YW2的熔融物可制得Y和W的单质 |
| C.相同条件下,W的氢化物水溶液酸性比Z弱 |
| D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |