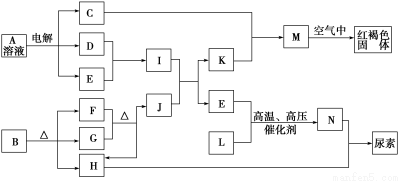
题目内容
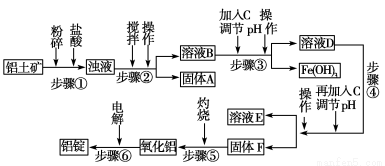
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。
一些氢氧化物沉淀的pH如下表。
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。
(1)过滤
(2)SiO2 NaOH溶液(其他合理答案也可)
(3)5.2<pH<10.4
(4)2Al2O3(熔融) 4 Al+3O2↑
4 Al+3O2↑
【解析】本题以工业生产铝锭的工艺流程为背景,考查内容包括pH的选择、过滤操作、常见金属元素及其化合物的主要性质等。SiO2是酸性氧化物不与盐酸反应,进行过滤操作(步骤②),得到固体A是SiO2;加入NaOH溶液,调节pH使Fe3+沉淀,步骤④是过滤得到氢氧化铝沉淀。步骤④为使Al3+完全沉淀,而Mg2+不能产生沉淀,需调节溶液的pH在5.2~10.4之间。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目