题目内容
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
① ;
② ;
③ ;
(2)二氧化硫是大气污染物之一,空
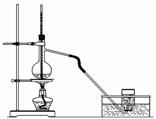
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:

①指出图中仪器a的名称: 。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有 性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变 色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明) 。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
① ;
② ;
③ ;
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:

①指出图中仪器a的名称: 。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有 性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变 色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明) 。
⑴①CH3CH2OH 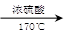 CH2=CH2 + H2O
CH2=CH2 + H2O
② 2CH3CH2OH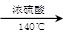 CH3CH2-O-CH2CH3 + H2O
CH3CH2-O-CH2CH3 + H2O
③ CH3CH2OH + H2SO4 (浓)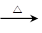 SO2 ↑+CO2 ↑+ H2O
SO2 ↑+CO2 ↑+ H2O
⑵分液漏斗 漂白 红色 向C中加入过量氢氧化钠溶液,振荡后静置
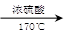 CH2=CH2 + H2O
CH2=CH2 + H2O② 2CH3CH2OH
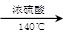 CH3CH2-O-CH2CH3 + H2O
CH3CH2-O-CH2CH3 + H2O③ CH3CH2OH + H2SO4 (浓)
 SO2 ↑+CO2 ↑+ H2O
SO2 ↑+CO2 ↑+ H2O ⑵分液漏斗 漂白 红色 向C中加入过量氢氧化钠溶液,振荡后静置
(1)考查乙醇的化学性质以及方程式的书写。乙醇中含有羟基可以发生消去反应生成乙烯,也可以发生分子间的脱水反应生成乙醚。因为浓硫酸还具有强氧化性,在加热的条件下乙醇可以被浓硫酸氧化生成CO2,而浓硫酸则被还原生成SO2。
(2)根据仪器的结构特点可判断a是分液漏斗。SO2具有漂白性,能使品红溶液褪色,同时SO2还是一种酸性氧化物,溶于水生成亚硫酸显酸性,所以紫色石蕊试液显红色。因为SO2是一种大气污染为,需要进行尾气处理,可以利用氢氧化钠溶液来吸收多余的SO2。
(2)根据仪器的结构特点可判断a是分液漏斗。SO2具有漂白性,能使品红溶液褪色,同时SO2还是一种酸性氧化物,溶于水生成亚硫酸显酸性,所以紫色石蕊试液显红色。因为SO2是一种大气污染为,需要进行尾气处理,可以利用氢氧化钠溶液来吸收多余的SO2。

练习册系列答案
相关题目
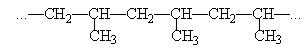
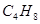 的烯烃有3种同分异构体,
的烯烃有3种同分异构体,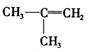 ; 和 。
; 和 。