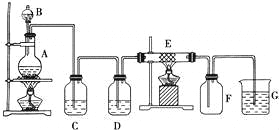
题目内容
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.已知常温下,有下列3个装置.下列说法中正确的是( )

A.①②中Mg作负极,③中Fe作负极
B.②中Al作正极,其电极反应式为Al﹣3e﹣=Al3+
C.③中Fe作负极,电极反应式为Fe﹣2e﹣=Fe2+
D.若①②中转移的电子数相同,则①②中产生的H2的量也一定相同
【答案】D
【解析】
试题分析:A.①中更活泼的金属镁失电子作负极,②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应,则铝作负极,③中铁在浓硝酸中会钝化,铜作负极;
B.②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝作负极失电子被氧化产生AlO2﹣;
C.③中铁在浓硝酸中会钝化,铜作负极发生氧化反应;
D.①②中产生的都是氢气,转移电子数相同,产生的氢气的量相同.
解:A.①中更活泼的金属镁失电子作负极,②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应,则铝作负极,③中铁在浓硝酸中会钝化,铜作负极,故A错误;
B.②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝作负极失电子被氧化,电极反应为:2Al+8OH﹣﹣6e﹣=2AlO2﹣+4H2O,Mg作为正极,电极反应式为6H2O+6e﹣═6OH﹣+3H2↑,故B错误;
C.③中铁在浓硝酸中会钝化,铜作负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu﹣2e﹣═Cu2+,故C错误;
D.①②中产生的都是氢气,H2~2e﹣,转移电子数相同,产生的氢气的量相同,故D正确;
故选D.

 名校课堂系列答案
名校课堂系列答案【题目】分现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
X | 地壳中含量最高的非金属元素 |
Y | M层比K层多1个电子 |
Z | 最外层电子数为内层电子数的0.6倍 |
W | 与氯形成的氯化物是生活中常用的调味品 |
(1)X形成的双原子分子的结构式为 ,X形成的氢化物的沸点在同族元素形成的氢化物中是 (填“最高”或“最低”),原因是 。
(2)金属冶炼Y单质的化学方程式为 。
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为 。
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是 (填化学式),检验该气体的常用试剂 。
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO(g) | CO2(g) | NaOH溶液、浓H2SO4 | 洗气 |
B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
A. A B. B C. C D. D