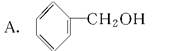
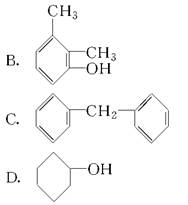
题目内容
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.
请填写下列空白:
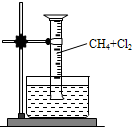
【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成.
(1)该反应的化学方程式为______;(只写第一步)
(2)水槽中盛放的液体最好为______;(填标号)
A.水B.饱和石灰水C.饱和食盐水D.饱和NaHCO3溶液
【实验二】用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成.
(3)该实验设计的错误之处______;
【实验三】
步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同).测得pH=3.26.
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入10mL蒸馏水,充分振荡,测得pH=1.00.
(4)判断该反应中有氯化氢生成的依据是______;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水.往反应后的溶液中加水稀释到100.00mL,取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为______mL.
请填写下列空白:
【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成.
(1)该反应的化学方程式为______;(只写第一步)
(2)水槽中盛放的液体最好为______;(填标号)
A.水B.饱和石灰水C.饱和食盐水D.饱和NaHCO3溶液
【实验二】用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成.
(3)该实验设计的错误之处______;
【实验三】
步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同).测得pH=3.26.
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入10mL蒸馏水,充分振荡,测得pH=1.00.
(4)判断该反应中有氯化氢生成的依据是______;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水.往反应后的溶液中加水稀释到100.00mL,取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为______mL.

(1)甲烷与氯气在光照下发生取代反应,甲烷分子中的氢原子被氯气分子中的氯原子取代,生成一氯甲烷和氯化氢,
故答案为:CH4+Cl2
CH3Cl+HCl;
(2)Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水,
故答案为:C;
(3)氯水中存在化学平衡:Cl2+H2O?H++Cl-+HClO;次氯酸是弱电解质,溶液中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-(少量),所以当氯水中加入AgNO3溶液时会发生Ag++Cl-=AgCl↓产生白色沉淀,
故答案为:氯水中加入AgNO3溶液也会产生白色沉淀;
(4)步骤一:氯气溶于水后,Cl2+H2O?H++Cl-+HClO生成盐酸,其pH为3.26,步骤二:pH=1.00,比3.26小,说明除了氯气溶于水生成盐酸外还有别的反应产生HCl,
故答案为:步骤二测得的pH值比步骤一测得的pH值低;
(5)取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,参加反应的银离子的物质的量为1×10-4mol,根据方程式 Ag++Cl-=AgCl↓则100.00mL溶液中含氯离子5×10-4mol,根据甲烷和氯气反应的原理,每1mol氯气参加反应生成1mol氯化氢,则试管中原有氯气为5×10-4mol,在标准状况下的体积为5×10-4mol×22.4L/mol═1.12×10-2L=11.2mL,故答案为:11.2.
故答案为:CH4+Cl2
| 光照 |
(2)Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水,
故答案为:C;
(3)氯水中存在化学平衡:Cl2+H2O?H++Cl-+HClO;次氯酸是弱电解质,溶液中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-(少量),所以当氯水中加入AgNO3溶液时会发生Ag++Cl-=AgCl↓产生白色沉淀,
故答案为:氯水中加入AgNO3溶液也会产生白色沉淀;
(4)步骤一:氯气溶于水后,Cl2+H2O?H++Cl-+HClO生成盐酸,其pH为3.26,步骤二:pH=1.00,比3.26小,说明除了氯气溶于水生成盐酸外还有别的反应产生HCl,
故答案为:步骤二测得的pH值比步骤一测得的pH值低;
(5)取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,参加反应的银离子的物质的量为1×10-4mol,根据方程式 Ag++Cl-=AgCl↓则100.00mL溶液中含氯离子5×10-4mol,根据甲烷和氯气反应的原理,每1mol氯气参加反应生成1mol氯化氢,则试管中原有氯气为5×10-4mol,在标准状况下的体积为5×10-4mol×22.4L/mol═1.12×10-2L=11.2mL,故答案为:11.2.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目