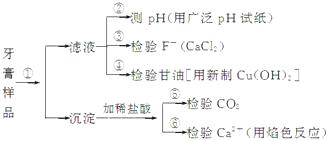
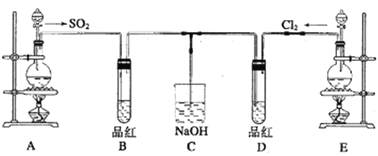
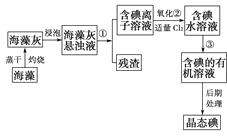
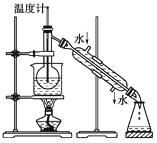
题目内容
【题目】
(1)第一电离能介于B、N之间的第二周期元素有种.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为。
(3)Fe3C晶体中碳元素为-3价,则其中基态铁离子的电子排布式为。
(4)甲醇(CH3OH)分子内的O-C-H键角(填“大于”、“等于”或“小于”)甲醛(H2C=O)分子内的O-C-H键角。
(5)BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是。
(6)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线吸收法可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 ![]() =(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
=(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
【答案】
(1)3
(2)C>H>Si
(3)[Ar]3d64s1
(4)小于
(5))BF3中B的杂化类型为sp2 , 形成3个共用电子对,无孤对电子,为平面三角形;NF3中N的杂化类型为sp3 , 形成3个共用电子对,还有一对孤对电子,因而为三角锥形
(6)3;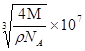
【解析】(1) 同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第V族元素原子最外层电子处于该轨道的全充满、半充满的稳定状态,所以其第一电离能大于其相邻元素,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)元素的非金属性越强,形成共价键时共用电子对就偏向哪种原子,该元素表现的化合价就是负价,CH4中共用电子对偏向C,则非金属性C>H;SiH4中硅元素为+4价,则非金属性H>Si,元素的非金属性越强,元素的电负性就越大,因此C、Si、H的电负性由大到小的顺序为C>H>Si;
(3) Fe3C晶体中碳元素为-3价,则Fe是+1价,Fe是26号元素,基态铁离子Fe+核外有25个电子,电子排布式为[Ar]3d64s1;
(4) 甲醇分子内C原子的杂化方式为sp3 杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2 杂化,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角;
(5)BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是BF3中B的杂化类型为sp2 , 形成3个共用电子对,无孤对电子,为平面三角形;NF3中N的杂化类型为sp3 , 形成3个共用电子对,还有一对孤对电子,因而为三角锥形;
(6) Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之相邻的Kr原子处于面心,每个顶点点Kr原子为8个晶胞共有,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有 (3×8)÷2=12,晶胞中含Kr原子为8×1/8+6×1/2=4,则m:n=12:4=3;已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则根据晶体密度计算公式可知: ![]() ,则表示Kr晶胞参数a=
,则表示Kr晶胞参数a= 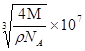 nm。
nm。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SO2 |
B | CO2 | NaOH | NaCl | Na2CO3 |
C | HCl | NaOH | CaF2 | CH3COOH |
D | HNO3 | KOH | CaCO3 | CaO |
A. A B. B C. C D. D