题目内容
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmolmin-1)与催化剂的对应关系如表所示。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________(填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1molL-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
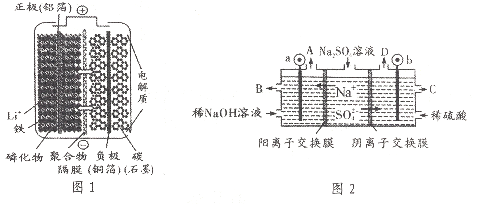
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________。
【答案】6c-a-3b Fe ![]() A
A 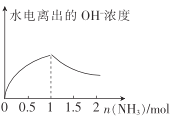 N2+6e-+6H+=2NH3 超过一定电压以后,H+得电子变成H2
N2+6e-+6H+=2NH3 超过一定电压以后,H+得电子变成H2
【解析】
(1)焓变=反应物总键能-生成物总键能;
(2)①反应速率越慢,活化能越大;
②利用“三段式”计算平衡常数Kp;
(3)根据影响反应速率、影响平衡移动的因素分析;
(4)盐酸、氨水抑制水电离,氯化铵促进水电离;
(5)①阴极氮气得电子生成氨气;
②根据图示,阴极有可能生成H2;
(1)焓变=反应物总键能-生成物总键能,N![]() N键、H—H键和N—H键的键能值分别记作a、b和c,2NH3(g)
N键、H—H键和N—H键的键能值分别记作a、b和c,2NH3(g)![]() N2(g)+3H2(g) △H=(6c-a-3b) kJmol-1;
N2(g)+3H2(g) △H=(6c-a-3b) kJmol-1;
(2)①根据表格数据,Fe作催化剂时反应速率最慢,氨气分解反应的活化能最大的是Fe;
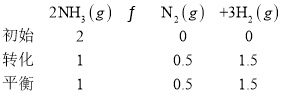
反应后气体的物质的量是反应前的![]() 倍,所以反应后的总压强为
倍,所以反应后的总压强为![]() ;Kp=
;Kp=
![]() ;
;
(3)A.合成氨工业常采用的反应温度为500℃左右,主要是为了加快反应速率,故A错误;
B.催化剂能加快反应速率,不能使平衡移动,使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率,故B正确;
C.加压,2NH3(g)![]() N2(g)+3H2(g) 平衡逆向移动,合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高,故C正确;
N2(g)+3H2(g) 平衡逆向移动,合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高,故C正确;
故选A;
(4)盐酸抑制水电离,在1L1molL-1盐酸中缓缓通入氨气,盐酸生成氯化铵,盐酸浓度减小,水电离程度增大,通入1mol氨气时,恰好生成氯化铵,水的电离程度达到最大,再通入氨气,生成氨水,抑制水电离;图象为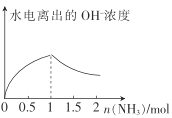 。
。
(5)①阴极氮气得电子生成氨气,阴极反应式是N2+6e-+6H+=2NH3;
②根据图示,随着电压的增大,阴极H+得电子变成H2,所以氨气的体积分数随着电压的增大而减小。

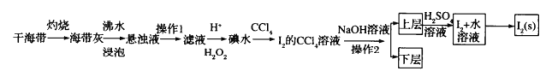
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如图:

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是___。
(2)步骤③加的试剂为___,目的是将溶液pH要调到5使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去。
(3)写出反应④的离子反应方程式___。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程___。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是___(填操作名称)。