题目内容
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:

(1)写出电解食盐水反应的离子方程式_______________________________________.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________________
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H =____________________
反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是____________________.
2MgCl4+Ti在Ar气氛中进行的理由是____________________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2______t(不考虑生产过程中物质的任何损失).
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
【答案】 2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑; 2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑; 2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO ﹣512 kJmol﹣1 Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
2FeCl3+2TiCl4+6CO ﹣512 kJmol﹣1 Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
【解析】试题分析:(1)电解食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;(2)根据题给流程知,钛铁矿与焦炭、氯气反应生成氯化铁、四氯化钛和一氧化碳,化学方程式为:2FeTiO3+6C+7Cl2
2OH-+H2↑+Cl2↑;(2)根据题给流程知,钛铁矿与焦炭、氯气反应生成氯化铁、四氯化钛和一氧化碳,化学方程式为:2FeTiO3+6C+7Cl2![]() 2TiCl4+2FeCl3+6CO;(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1,根据盖斯定律:①×2—②得2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH=-512 kJmol-1 ;反应2Mg+TiCl4
2TiCl4+2FeCl3+6CO;(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1,根据盖斯定律:①×2—②得2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH=-512 kJmol-1 ;反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应;(4)在上述产业链中,合成甲醇的反应为:CO+2H2
2MgCl4+Ti在Ar气氛中进行的理由是防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应;(4)在上述产业链中,合成甲醇的反应为:CO+2H2![]() CH3OH,根据化学方程式2Cl-+2H2O
CH3OH,根据化学方程式2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑、2FeTiO3+6C+7Cl2
2OH-+H2↑+Cl2↑、2FeTiO3+6C+7Cl2![]() 2TiCl4+2FeCl3+6CO计算合成192 t甲醇理论上需额外补充H210t;(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是CH3OH+8OH--6e—=CO32-+6H2O。
2TiCl4+2FeCl3+6CO计算合成192 t甲醇理论上需额外补充H210t;(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是CH3OH+8OH--6e—=CO32-+6H2O。

【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
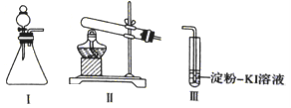
供选试剂:30%H2O2溶液、0.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向I的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
