题目内容
己知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是
- A.原子半径:D>B>E>C>A
- B.单质D可用海水作原料获得
- C.热稳定性:EA4>A2C
- D.化合物DC与化合物EC2中化学键类型相同
B
试题分析:A、B形成的气态化合物的水溶液呈碱性,该氢化物是氨气。又因为A、B、C、D、E是短周期中原子序数依次增大的5种元素,所以A是H,B是N。D原子最外层电子数与最内层电子数相等,D是第三周期元素,所以D是Mg。D与C形成的化合物是一种耐高温材料,所以C是O,该化合物是氧化镁。A、B、C、D的原子序数之和是E的两倍,所以E的原子序数是(1+7+8+12)÷2=14,即E是Si。A、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径是D>E>B>C>A,A不正确;B、海水中含有大量的镁元素,所以单质Mg可用海水作原料获得,B正确;C、非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于硅元素的,则稳定性是H2O>SiH4,C不正确;D、化合物MgO与化合物SiO2中化学键类型不相同,前者是离子键,后者是极性键,D不正确,答案选B。
考点:考查元素周期表的结构和元素周期律的应用
试题分析:A、B形成的气态化合物的水溶液呈碱性,该氢化物是氨气。又因为A、B、C、D、E是短周期中原子序数依次增大的5种元素,所以A是H,B是N。D原子最外层电子数与最内层电子数相等,D是第三周期元素,所以D是Mg。D与C形成的化合物是一种耐高温材料,所以C是O,该化合物是氧化镁。A、B、C、D的原子序数之和是E的两倍,所以E的原子序数是(1+7+8+12)÷2=14,即E是Si。A、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径是D>E>B>C>A,A不正确;B、海水中含有大量的镁元素,所以单质Mg可用海水作原料获得,B正确;C、非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于硅元素的,则稳定性是H2O>SiH4,C不正确;D、化合物MgO与化合物SiO2中化学键类型不相同,前者是离子键,后者是极性键,D不正确,答案选B。
考点:考查元素周期表的结构和元素周期律的应用

练习册系列答案
相关题目
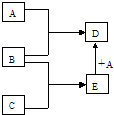 己知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
己知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
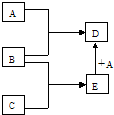 己知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
己知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).