题目内容
10.氮气在常况下是一种无色无味无臭的气体,切无毒.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:(1)氮气的结构式:N≡N;氮元素原子的L层电子数为5.
(2)氮化镁与水反应的化学方程式为Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为2NH3+NaClO═N2H4+NaCl+H2O.
(4)SO2和NO2是形成酸雨的主要物质.某学习小组学生通过实验探究NO参与的硫酸型酸雨的形成.他们在烧瓶中充入含有少量一氧化氮气体,慢慢充入氧气.请推断该过程中发生反应的化学方程式为2NO+O2=2NO2、NO2+SO2=SO3+NO,若用蒸馏水可得硫酸型酸雨,其中一氧化氮的作用为催化剂.
(5)工业上用碳酸钠溶液浸泡锅炉水垢,使其中硫酸钙能转化为碳酸钙,再用酸出去碳酸钙,其理由是因为硫酸钙溶解度大于碳酸钙,硫酸钙可以转化物碳酸钙,碳酸钙易溶于酸中.
分析 (1)氮气分子中两个氮原子共用3对电子,氮原子核外有2个电子层最外层容纳电子数为5;
(2)氮化镁与水反应生成氢氧化镁与氨气;
(3)NH3与NaClO反应可得到肼、氯化钠和水;
(4)根据物质的性质来书写方程式,根据一氧化氮在反应中的特点来判断所起到的作用;
(5)硫酸钙不与盐酸反应,碳酸钙易溶于盐酸,依据沉淀转化规律解答.
解答 解:(1)氮气分子中两个氮原子共用3对电子,结构式为:N≡N,氮原子核外有2个电子层最外层容纳电子数为5;
故答案为:N≡N;5;
(2)氮化镁与水反应生成氢氧化镁与氨气,化学方程式:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;
故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;
(3)NH3与NaClO反应可得到肼、氯化钠和水,化学方程式:2NH3+NaClO═N2H4+NaCl+H2O;
故答案为:2NH3+NaClO═N2H4+NaCl+H2O;
(4)一氧化氮具有还原性,很容易被氧气氧化,反应的方程式为:2NO+O2=2NO2,二氧化氮能将二氧化硫氧化,反应的化学方程式为:NO2+SO2=SO3+NO,总反应为:2SO2+O2=2SO3,可见整个过程一氧化氮的质量没有变化,故NO在反应中作催化剂,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;催化剂;
(5)硫酸钙不与盐酸反应,碳酸钙易溶于盐酸,故锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去,
故答案为:因为硫酸钙溶解度大于碳酸钙,硫酸钙可以转化物碳酸钙,碳酸钙易溶于酸中.
点评 本题考查了元素化合物知识,侧重考查化学方程式书写,明确氮气及化合物性质是解题关键,注意沉淀转化规律,题目难度不大.

练习册系列答案
相关题目
4.关于如图的说法中,不正确的是( )
| A. | 如图电解一段时间后溶液颜色变浅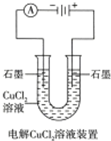 | B. | 如图待镀铁制品与电源负极相连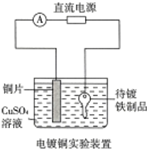 | ||
| C. | 如图电子由b极流向a极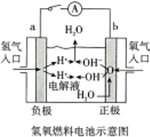 | D. | 如图阴极反应式:Ix-+(x-1)e-=xI-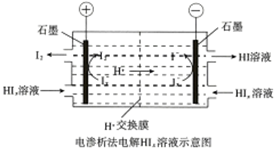 |
2.乙酸乙酯的制备实验中,得到乙酸乙酯、乙酸和乙醇的混合物.下列有关分离、提纯的方法可行的是( )
| A. | 在混合物中继续加浓硫酸,加热可得到纯净的乙酸乙酯 | |
| B. | 先加入氢氧化钠浓溶液,再进行蒸馏可得到乙酸乙酯 | |
| C. | 先加入饱和碳酸钠溶液,再进行分液可得到乙酸乙酯 | |
| D. | 分离出乙酸乙酯后的混合液,可继续用分液漏斗分离乙酸和乙醇 |
5.下列说法不正确的是( )
| A. | 氧化亚铜和硝酸反应:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO+7H20,属于氧化还原反应 | |
| B. | Cl2+SO2+2H2O═H2SO4+2HCl属于氧化还原反应 | |
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)2属于氧化还原反应和化合反应 | |
| D. | 金属单质与盐溶液的反应都是置换反应 |
15.空气污染物通常以气态形式进入地面或低层大气环境.空气污染物与其主要来源不对应的是D
| 污染物 | 来源 | |
| A | HCHO | 家具生产与使用、质量低劣的涂料的使用 |
| B | NO和NO2 | 燃煤的使用、汽车尾气 |
| C | 悬浮颗粒物 | 建筑施工、燃煤的使用 |
| D | SO2 | 雷电时在空气中产生 |
2.同温同压下,对下列气体叙述不正确的是( )
| A. | 8gO2和1gH2体积为1:2 | B. | NH3和H2S密度比为1:2 | ||
| C. | 5L N2和4L CH4原子数比为1:2 | D. | 2mol CO2和1mol CO分子数比为2:1 |
19.如表中所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3中混杂的NaCl | 重结晶 | 氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
20.下列溶液中,跟100mL 1.0mol•L -1AlCl3溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 200mL 1.5 mol•L-1CaCl2溶液 | ||
| C. | 50mL 1 mol•L-1NaCl溶液 | D. | 25mL 0.5 mol•L-1vHCl溶液 |