题目内容
(8分)用双线桥标出下列反应中的电子转移的方向及数目,并指出氧化剂和还原剂
(1)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
氧化剂是 ,还原剂是 ,
(2)2FeCl3+2HI=2FeCl2+2HCl+I2
氧化剂是 ,还原剂是
(1)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
氧化剂是 ,还原剂是 ,
(2)2FeCl3+2HI=2FeCl2+2HCl+I2
氧化剂是 ,还原剂是
(1)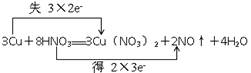 氧化剂是 HNO3,还原剂是 Cu
氧化剂是 HNO3,还原剂是 Cu
(2)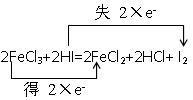 氧化剂是 FeCl3 ,还原剂是 HI
氧化剂是 FeCl3 ,还原剂是 HI
 氧化剂是 HNO3,还原剂是 Cu
氧化剂是 HNO3,还原剂是 Cu(2)
 氧化剂是 FeCl3 ,还原剂是 HI
氧化剂是 FeCl3 ,还原剂是 HI试题分析:(1)根据方程式可知,铜元素的化合价从0价升高到+2价失去2个电子,铜是还原剂。硝酸支氮元素的化合价从+5价降低到+2价,得到3个电子,硝酸做氧化剂。
(2)铁元素的化合价从+3价降低到+2价,得到1个电子,氯化铁是氧化剂。碘化氢中碘元素的化合价从-1价升高到0价,失去1个电子,做还原剂。
点评:物质失去电子,所含元素化合价升高的做还原剂,反之得到电子,物质所含元素化合价降低的做氧化剂,据此可以进行有关判断和计算。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
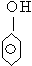 与
与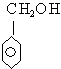 互为同系物
互为同系物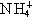 粒子的空间构型均为正四面体;晶体硅、碳化硅均为原子晶体
粒子的空间构型均为正四面体;晶体硅、碳化硅均为原子晶体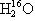 、
、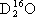 、
、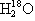 、
、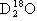 互为同素异形体
互为同素异形体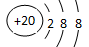 ,NH4CI的电子式为
,NH4CI的电子式为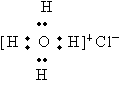

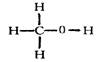
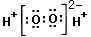
 2H++S2-
2H++S2- 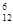 C
C