��Ŀ����
����Ŀ����ͼ��Ԫ�����ڱ��IJ��֣���Ա��е�10��Ԫ�أ���Ԫ�ط��Ż�ѧʽ�ش��������:
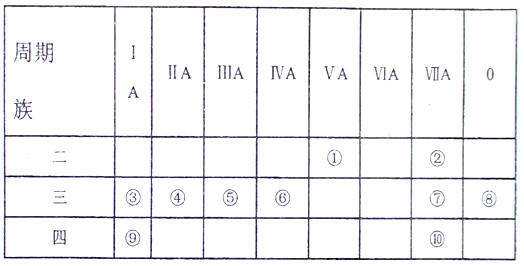
��1���������������ӽṹʾ��ͼ_________��
��2����ЩԪ���е�����������Ӧ��ˮ�����У�������ǿ����______��������ǿ����_____��
��3����������ͨ����������ɵĻ������ˮ��Һ�У�������Ӧ�����ӷ���ʽΪ_________��
��4��д���������ʵĵ���ʽ:
���γɵĵ���_________ �������γɵ�����_________
�õ���ʽ��ʾ��������������ʵ��γɹ���_______________��
���𰸡�  HClO4 KOH Cl2+2Br-=Br2+2Cl-
HClO4 KOH Cl2+2Br-=Br2+2Cl- ![]()
![]()
![]()
����������Ԫ�������ڱ���λ�ÿ���֪������~��Ԫ�طֱ�ΪN��F��Na��Mg��Al��Si��Cl��Ar��K��Br��
(1)����Ԫ��Ϊþ���˵����Ϊ12��ԭ�ӽṹʾ��ͼΪ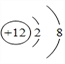 ����ȷ����
����ȷ���� ��
��
��2��Ԫ�صĽ�����Խǿ����Ԫ������������Ӧ��ˮ����ļ��Ծ�Խǿ��Ԫ�صķǽ�����Խǿ����Ԫ������������Ӧ��ˮ��������Ծ�Խǿ�����Ԫ�ص�����������Ӧ��ˮ������������ǿ����![]() ��������ǿ����KOH����ȷ����HClO4 �� KOH ��
��������ǿ����KOH����ȷ����HClO4 �� KOH ��
��3���������ɵĻ�����Ϊ�廯�ƣ��ߺ�Ԫ�صĵ���Ϊ�����������ܹ��������������ɵ����壬��Ӧ�����ӷ���ʽΪ��Cl2+2Br-=Br2+2Cl- �� ��ȷ����Cl2+2Br-=Br2+2Cl-��
��4�����γɵĵ���Ϊ������Ϊ���ۼ��γɵĵ��ʣ�����ʽΪ![]() ��������γɵ�����Ϊ��������Ϊ���ӻ�����������ʽΪ
��������γɵ�����Ϊ��������Ϊ���ӻ�����������ʽΪ![]() ����������������Ϊ�Ȼ�þ��Ϊ���ӻ�������γɹ���Ϊ
����������������Ϊ�Ȼ�þ��Ϊ���ӻ�������γɹ���Ϊ![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��![]() ��
��![]() ��
��

 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�����Ŀ����ȥ���������е����ʣ�������Ϊ���ʣ������õ��Լ��ͳ��ӷ���������ǣ� ��
ѡ�� | �����ʵ����� | �Լ� | ���ӷ��� |
A | C2H4��SO2�� | NaOH��Һ | ϴ�� |
B | C6H6�����ӣ� | ŨBr2ˮ | ���� |
C | C6H5NO2��HNO3�� | NaOH��Һ | ��Һ |
D | C2H2��H2S�� | CuSO4��Һ | ϴ�� |
A.A
B.B
C.C
D.D