题目内容
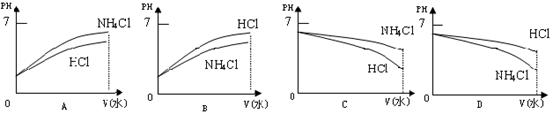
将pH相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸溶液)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,则(①-④)填写>、<或=)
①反应需要的时间乙______甲
②开始时反应的速率甲______乙
③参加反应的锌的质量甲______乙
④整个反应阶段的平均速率乙______甲
⑤甲容器中有______剩余
⑥乙容器中有______剩余.
①反应需要的时间乙______甲
②开始时反应的速率甲______乙
③参加反应的锌的质量甲______乙
④整个反应阶段的平均速率乙______甲
⑤甲容器中有______剩余
⑥乙容器中有______剩余.
①醋酸是弱酸,随反应的进行会不断电离出氢离子,所以氢离子浓度有增大的趋势,所以整个阶段的平均速率:醋酸>盐酸;
②开始反应速率取决于溶液中开始阶段的氢离子浓度大小,pH相同的盐酸和醋酸溶液,起始氢离子浓度一样大,所以开始反应速率:盐酸=醋酸;
③参加反应的锌的质量和生成的氢气的量有关,因为产生气体体积相同,所以参加反应的锌的质量:醋酸=盐酸;
④醋酸是弱酸,随反应的进行会不断电离出氢离子,所以氢离子浓度有增大的趋势,所以整个阶段的平均速率:醋酸>盐酸;
⑤醋酸为弱酸,pH相同时,醋酸浓度大,若最后有一溶液中有锌剩余,只能是盐酸中的锌剩余;
⑥由⑤分析可知醋酸过量,
故答案为:<;=;=;>;锌;醋酸.
②开始反应速率取决于溶液中开始阶段的氢离子浓度大小,pH相同的盐酸和醋酸溶液,起始氢离子浓度一样大,所以开始反应速率:盐酸=醋酸;
③参加反应的锌的质量和生成的氢气的量有关,因为产生气体体积相同,所以参加反应的锌的质量:醋酸=盐酸;
④醋酸是弱酸,随反应的进行会不断电离出氢离子,所以氢离子浓度有增大的趋势,所以整个阶段的平均速率:醋酸>盐酸;
⑤醋酸为弱酸,pH相同时,醋酸浓度大,若最后有一溶液中有锌剩余,只能是盐酸中的锌剩余;
⑥由⑤分析可知醋酸过量,
故答案为:<;=;=;>;锌;醋酸.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(14分)
现有A、B、C、D、E五种强电解质,分别含有下列阴阳离子(离子不可重复)。
| 阴离子 |
|
| 阳离子 |
|
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②A、E两溶液反应既有气体,又有沉淀生成,A、C两溶液反应只有气体产生。
③D与其他四种溶液反应,均产生沉淀,C只与D反应产生沉淀。
试回答下列问题:
(1)写出:①B的化学式 ,②D与A反应生成难溶物的![]() 表达式 。
表达式 。
(2)A与E在溶液中反应的离子方程式为 。
(3)将pH相同的等体积A、B两种溶液稀释相同倍数后,溶液的pH关系是:![]()
![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)将C溶液逐滴加入到等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为 。
(5)在100mL 0.1![]() E溶液中,逐渐中入35 mL 2
E溶液中,逐渐中入35 mL 2![]()
![]() 溶液,最终得到沉淀的物质的量为 mol。
溶液,最终得到沉淀的物质的量为 mol。