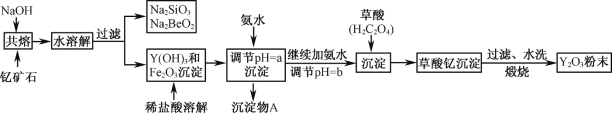
题目内容
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题:
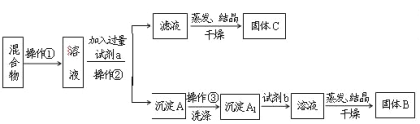
(1)操作①的名称是_________。操作②的名称是____________。
(2)试剂a是_________,试剂b是_________,固体B是________,固体C是________。
(3)加入试剂a所发生反应的离子方程式为:_________________________。
加入试剂b所发生反应的方程式为:____________________________。
(4)该方案能否达到实验目的:_____________。若不能,应如何改进(若能,此问不用回答)? _____________________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是_____的质量。
【答案】(1)溶解 过滤
(2)K2CO3 MCl BaCl2 K2CO3和 KC1
(3)CO32-+Ba2+=BaCO3↓ BaCO3+2HCl=BaCl2+CO2↑+H2O
(4)否(不能)应在操作②的滤液中加入过量盐酸后再蒸发结晶
(5)沉淀A1或固体B
【解析】
试题分析:分离NaCl和BaCl2两种固体混合物,可先溶于水,然后加入过量Na2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为NaCl和Na2CO3的混合物,应加入过量盐酸可得NaCl;
(1)操作①的名称是溶解固体,操作②的名称是过滤;
(2)固体溶解后加入过量Na2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,a为Na2CO3,b为盐酸,流程分析可知固体B为氯化钡,固体C是K2CO3和 KC1;
(3)加入过量Na2CO3使BaCl2转化为沉淀,试剂a为碳酸钠;发生的反应是钡离子和碳酸根离子反应生成沉淀碳酸钡,反应的离子方程式为:Ba2++CO32-═BaCO3↓,反应过程中试剂b为盐酸,是利用盐酸溶解碳酸钡得到氯化钡溶液,反应的离子方程式为:BaCO3+2H+=H2O+CO2↑+Ba2+;
(4)操作②所得滤液为NaCl和Na2CO3的混合物蒸发结晶干燥,得到固体C为氯化钠和碳酸钠的混合物,不能分离得到氯化钠,需要加入适量盐酸除去碳酸钠,到不再生成气体得到较纯净的氯化钠溶液,该方案不能达到实验目的;
(5)固体溶解后加入过量K2CO3使BaCl2转化为碳酸钡沉淀,过滤后沉淀加入试剂b盐酸可将碳酸钡转化成BaCl2溶液,然后经蒸发、结晶、干燥后可得固体BaCl2,若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或沉淀A’的质量,依据B为BaCl2计算得到质量分数,A'为碳酸钡,结合钡元素守恒计算氯化钡质量得到。

 阅读快车系列答案
阅读快车系列答案【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ