题目内容
【题目】镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形态,被广泛应用于电子工业。
(1)Ga的原子序数为______。
(2)半导体材料氮化稼是由Ga与NH3在一定条件下合成的,该过程中每生成3molH2时,就会放出30.8kJ的热量。
①反应的热化学方程式是________。
②反应的化学平衡翻常数表决达式是_________________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____(填字母代号).

A.Ⅰ图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图象中纵坐标可以为稼的转化率
C.Ⅲ图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体的平均相对分子质量
(3)工业上多用电解精炼法提纯稼。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①X为电源的_____极,电解精炼稼时阳极泥的成分是__________;
②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼, 请写出该电解过程中的电极反应方程式:阳极_________;阴极_________。
【答案】 31 2Ga(s)+ 2NH3(g)![]() 2GaN(s)+3H2(g) △H=-30.8kJ/mol
2GaN(s)+3H2(g) △H=-30.8kJ/mol  A 正 Fe和Cu Ga-3e-+4OH-=GaO2-+2H2O GaO2-+3e-+2H2O=Ga+4OH-
A 正 Fe和Cu Ga-3e-+4OH-=GaO2-+2H2O GaO2-+3e-+2H2O=Ga+4OH-
【解析】镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形态,被广泛应用于电子工业。
(1)镓(Ga)位于周期表的第四周期,与Al同主族,Ga的原子序数为13+18=31。(2)半导体材料氮化稼是由Ga与NH3在一定条件下合成的,该过程中。
①每生成3molH2时,就会放出30.8kJ的热量,因此反应的热化学方程式是2Ga(s)+ 2NH3(g)![]() 2GaN(s)+3H2(g) △H=-30.8kJ/mol。②根据方程式可知反应的化学平衡翻常数表决达式K=
2GaN(s)+3H2(g) △H=-30.8kJ/mol。②根据方程式可知反应的化学平衡翻常数表决达式K=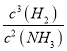 。③A.Ⅰ图象中如果纵坐标为正反应速率,正反应是放热的、体积增大的可逆反应,升高温度或增大压强平衡均向逆反应方向进行,A正确;B.增大压强平衡向逆反应方向进行,转化率降低,B错误;C.改变固体质量反应速率不变,C错误;D.升高温度或增大压强平衡均向逆反应方向进行,混合气体的平均相对分子质量增大,D错误,答案选A。(3)①X电极是粗Ga,是阳极,则X为电源的正极,金属的活动性Zn>Ga>Fe>Cu,所以铁和铜不会生气电子,则电解精炼稼时阳极泥的成分是 Fe和Cu;②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼,由于溶液显碱性,因此该离子是GaO2-,电解过程中的电极反应方程式为阳极:Ga-3e-+4OH-=GaO2-+2H2O;阴极:GaO2-+3e-+2H2O=Ga+4OH-。
。③A.Ⅰ图象中如果纵坐标为正反应速率,正反应是放热的、体积增大的可逆反应,升高温度或增大压强平衡均向逆反应方向进行,A正确;B.增大压强平衡向逆反应方向进行,转化率降低,B错误;C.改变固体质量反应速率不变,C错误;D.升高温度或增大压强平衡均向逆反应方向进行,混合气体的平均相对分子质量增大,D错误,答案选A。(3)①X电极是粗Ga,是阳极,则X为电源的正极,金属的活动性Zn>Ga>Fe>Cu,所以铁和铜不会生气电子,则电解精炼稼时阳极泥的成分是 Fe和Cu;②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼,由于溶液显碱性,因此该离子是GaO2-,电解过程中的电极反应方程式为阳极:Ga-3e-+4OH-=GaO2-+2H2O;阴极:GaO2-+3e-+2H2O=Ga+4OH-。