题目内容
8.制印刷电路时,常用氯化铁溶液作为腐蚀液,其反应为2FeCl3+Cu═2FeCl2+CuCl2.现向氯化铁溶液中加入a g铜,完全溶解后,再加入b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是( )| A. | 残余固体全部是铜 | |
| B. | 残余固体可能为铁和铜的混合物 | |
| C. | 最后得到的溶液可能含有Fe3+ | |
| D. | 残余固体是铁,溶液中一定不含Cu2+ |
分析 在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向盛有FeCl3溶液的烧杯内分别加入铁粉和铜粉,铁能与氯化铁反应生成氯化亚铁,铜能与氯化铁反应生成氯化亚铁和铜,利用此知识解决即可.
解答 解:此题中发生的化学反应有三个,方程式如下:2FeCl3+Cu=2FeCl2+CuCl2;CuCl2+Fe=FeCl2+Cu;2FeCl3+Fe=3FeCl2
依元素守恒可知
步骤一:ag铜完全溶解后,变为ag铜离子,
步骤二:若加入的铁足够多的话,可将溶液中的铜离子全部变回金属铜(ag)甚至还会有铁剩余,此时,残余固体(cg)应大于或等于ag,
依题意:a>c可知,加入的铁是不足量的,此时溶液中还有部分铜未完全置换出来.
结论1:剩余固体为Cu,不可能有Fe剩.选A
步骤三:根据方程式1、2、3可知,溶液中一定有Fe2+,因上述推导可知,溶液中还应有Cu2+剩余,由方程式1可知,Cu与Fe3+是不能共存的,剩余固体中有Cu,则溶液中必无Fe3+
结论2:充分反应后剩余固体为Cu,而溶液中含FeCl2和CuCl2.
故选A.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行,要注意根据铁和铜的活动性强弱确定反应的先后顺序,题目难度中等.

练习册系列答案
相关题目
16.用NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 14gCnH2n中含有的氢原子数目为2NA | |
| B. | 14g乙烯和丙烯的混合物中含有共价键总数为3NA | |
| C. | 标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA | |
| D. | 1molC10H22分子中共价键总数为31NA |
3.下列说法错误的是( )
| A. | 碱金属元素最外层电子数都是1个,化学性质均活泼 | |
| B. | 碱金属元素从上到下随电子层数的增多金属性依次增强 | |
| C. | 碱金属元素的单质都是银白色的,都比较柔软 | |
| D. | 碱金属元素的单质从上到下熔沸点逐渐降低 |
13.下列说法正确的是( )
| A. | 化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率 | |
| B. | 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 | |
| C. | 同一化学反应中,化学反应速率可用反应物浓度的改变表示,也可用生成物浓度的改变表示,其值可能相同,也可能不同 | |
| D. | 化学反应速率的单位可以是g/(L•s),也可以是kg/(L•s) |
20.已知热化学方程式H2 (g)+Br2 (l)→2HBr(g)+72.8kJ.下列叙述正确的是( )
| A. | 该反应放热,无需加热即可反应 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 1molH2与1molBr2反应放出72.8kJ热量 | |
| D. | H2 (g)+Br2 (g)→2HBr(g)+Q,Q>72.8kJ |
17.下列有关胶体的叙述正确的是( )
| A. | 胶体的分散质粒子直径比溶液的大,故胶粒不能透过滤纸 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | Fe(OH)3胶体粒子在电场的作用下将向阴极运动,说明Fe(OH)3胶体粒子带正电,这是胶体粒子做布朗运动的表现 | |
| D. | 分离胶体和某盐溶液,可用过滤的方法 |
 依据所学知识回答:
依据所学知识回答:
 ;这样制取的溴苯可以用AD洗涤除Br2.
;这样制取的溴苯可以用AD洗涤除Br2.

 FeBr3+
FeBr3+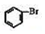 +HBr;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是有水情况下,无法生成Br+.
+HBr;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是有水情况下,无法生成Br+.