题目内容
(8分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
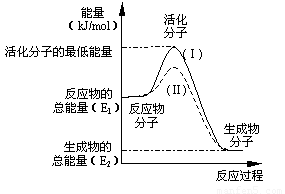
(1)图中所示反应是_____________(填“吸热”或“放热”)反应,该反应的△H=____________ kJ·mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1。该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为 kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是 。
【答案】
(1)放热(2分) -(E1-E2)(2分) (2)409 (2分)
(3)使用了正催化剂(2分)
【解析】(1)观察图像,得:反应物总能量大于生成物总能量,则该反应是放热反应,
△H的绝对值= E1-E2,而放热反应的△H<0,故△H=-(E1-E2);
(2)相当于图像中:E1-E2=241.8kJ·mol-1,活化分子能量- E1 =167.2kJ·mol-1,
则逆反应的活化能=活化分子能量- E2 =(活化分子能量- E1)+(E1-E2)=167.2kJ·mol-1+241.8kJ·mol-1=409 kJ·mol-1;
(3)使用正催化剂,能降低反应的活化能;

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
 Ⅰ:反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答:
Ⅰ:反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答: 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.请认真观察下图,然后回答问题.