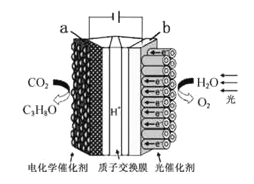
��Ŀ����
����Ŀ����ͭ�ǹ㷺Ӧ�������������Ԫ�������úϽ�ij����С���ij�Ͼ���ͭԪ��(��BeO:25%��CuS:71%������FeS��SiO2)�л������ͭ���ֽ����Ĺ�����������:

��֪:I.�롢��Ԫ�ػ�ѧ��������
II.������:Ksp[Cu(OH)2]=2.2��10-20��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Mn(OH)2]=-2.1��10-13
(1)��ҺA����Ҫ�ɷֳ�NaOH�⣬����_____ (�ѧʽ)��д����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽ_____________��
(2)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2��ѡ�����������˳��______��
a.���������NaOH b.ͨ�������CO2 c.��������İ�ˮ
d.����������HC1 e.���� f.ϴ��
�ڴ�BeCl2��Һ�еõ�BeCl2����IJ�����________________��
(3)��MnO2�ܽ����������е���Ԫ������Ϊ���ʣ�д����ӦII��CuS ������Ӧ�Ļ�ѧ����ʽ______________��
������ŨHNO3�ܽ�������ȱ����____________(��дһ��)��
(4)��ҺD�к�c(Cu2+)=2.2mol/L��c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L����μ���ϡ��ˮ����pH�����η��룬���ȳ�������___ (�����ӷ���)��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pHֵ����____��
���𰸡� Na2SiO3��Na2BeO2 BeO22-+4H+=Be2++2H2O cefd ���Ȼ��������������ᾧ���������ᾧʱ����Һ�г���ͨ���Ȼ������壩 MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O ������Ⱦ���������� Fe3+ 4
�����������黯ѧ�������̣���1������ͭԭ���ijɷ�BeO��CuS��FeS��SiO2��������ϢI��BeO�������������CuS��������������Һ��Ӧ��FeS�����������Ʒ�Ӧ��SiO2���������������������������Һ��Ӧ�������ҺA����Ҫ�ɷ���NaOH��Na2SiO3��Na2BeO2��������ϢI��BeO2����������ᷴӦ�����Ȼ����ˮ�������ӷ���ʽΪBeO22��+4H��=Be2��+2H2O���𰸣�Na2SiO3��Na2BeO2��BeO22-+4H+=Be2++2H2O��
��2��������BeԪ�ء���Ԫ�ػ�ѧ�������ƣ�����ҺC���ȼ�������İ�ˮ������Be(OH)2������Ȼ����ˡ�ϴ�ӣ��ټ���������HCl������BeCl2������������cefd��
��Ϊ������Be2����ˮ�⣬�����Ҫ��HCl�ķ�Χ�ж�BeCl2��Һ�����ᾧ��
��3���ٸ�����Ϣ��CuS��Sת��ΪS���ʣ�MnO2��Mn����ԭΪMn2�������ݻ��ϼ�������������ƽ���仯ѧ��Ӧ����ʽΪMnO2+CuS+2H2SO4=S��+MnSO4+CuSO4+2H2O������Ũ��������������ŨHNO3����ԭ��NO2��NO2�ж���Ⱦ������
��4�����ֽ��������ӳ��ֳ���������Ũ������Ksp�Ĺ�ϵ��Cu2��ת���ɳ�����c(OH��)= mol��L��1��Fe3��ת���ɳ�����c(OH��)=
mol��L��1��Fe3��ת���ɳ�����c(OH��)=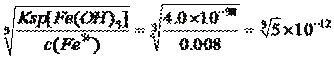 mol��L��1��Mn2��ת���ɳ�����c(OH��)=
mol��L��1��Mn2��ת���ɳ�����c(OH��)=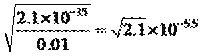 mol��L��1��������ȳ�������Fe3����ΪʹCu2����������ʱc(OH��)=1��10��10mol��L��1��c(H��)=10��14/10��10=10��4mol��L��1����pH=4����pH>4ʱ��Cu2�����ֳ�����
mol��L��1��������ȳ�������Fe3����ΪʹCu2����������ʱc(OH��)=1��10��10mol��L��1��c(H��)=10��14/10��10=10��4mol��L��1����pH=4����pH>4ʱ��Cu2�����ֳ�����

����Ŀ��

��ش��������⣺
��1��ʵ����ֻ��100 mL��250 mL��500 mL���ֹ�������ƿ����Ҫ����480 mL 0.50 mol/L��ϡ���ᣬ��ȡ��Ũ���� mL��
��2����������ɴ�ʵ���㽫�õ���������20 mL��Ͳ���ձ�����������____________��
��3��Ҫ��������Һ��ȡ��50 mLʢװ���Լ�ƿ�У��������ϱ�ǩ�����ǩ��������________________�����ٴ���ȡ��10 mL��Һϡ����20 mL����ϡ�ͺ���Һ�����ʵ���Ũ��Ϊ__________��
��4�����в�����ʹ������ҺŨ��ƫ�͵��� ��
A������Ͳ��ȡŨ���ᣬ����ʱ���ӿ̶��� |
B��ת����Һʱδϴ���ձ� |
C������ƿ������ˮϴ�����Բ���������ˮ |
D������ʱ��������ƿ�Ŀ̶��� |
E������ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶���