题目内容
【题目】(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________
(2)如图是某温度下,N2与H2反应过程中能量变化的曲线图。
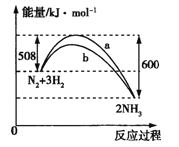
a、b两条曲线产生区别的原因很可能是________________。
(3)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)时放出571.6 kJ热量,则H2的热值为________
(4)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
由Fe(s)和O2(g)反应生成Fe2O3(s)的热化学方程式为_______________________________。
【答案】 S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ/mol 催化剂 142.9 kJ·g-1 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1641.0 kJ·mol-1
【解析】试题分析:(1) 16 g固体硫完全燃烧时放出148.4 kJ的热量,可知1mol硫完全燃烧放出296.8 kJ的能量;
(2)根据图像可知,曲线b是反应的活化能降低了,反应的焓变不变。
(3)H2的热值是1g氢气完全燃烧放出的热量。
(4)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
根据盖斯定律判断由Fe(s)和O2(g)反应生成Fe2O3(s)的热焓变。
解析:(1) 1mol硫完全燃烧放出296.8 kJ的能量,固体硫完全燃烧的热化学方程式为S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ/mol;
(2)根据图像可知,曲线b是反应的活化能降低了,反应的焓变不变,所以a、b两条曲线产生区别的原因很是b使用了高效催化剂。
(3)H2的热值是1g氢气完全燃烧放出的热量,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)时放出571.6 kJ热量,H2的热值是571.6 kJ÷4=142.9 kJ·g-1。
(4)已知:①Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
②CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
③C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
根据盖斯定律,③×6-②×6-①×2得,4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1641.0 kJ·mol-1;

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案


