��Ŀ����
��14�֣���ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ�__________
| A������CH3OH������������CO��������� | B�����������ܶȲ��� |
| C�������������ƽ�������������� | D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯 |
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�ٸ÷�Ӧ��ѧƽ�ⳣ������ʽK=
���ɱ��������жϸ÷�Ӧ�ġ�H__________0���>������=����<������
��ij�¶��£���2molCO��6mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���C(CO)=0.2mol��L-1����ʱ���¶�Ϊ__________
��3��25��101KPa�£�1gҺ̬�״���ȫȼ������CO2��Һ̬ˮʱ�ų�����22.68kJ����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ
��4���ݱ��������Ħ��������˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ������ɴ�����ʹ�õ������ػ�﮵�ص�ʮ�����õ�ع���ʱ�����缫��ӦʽΪ ������Ӧʱ����16g�״��������ĵ��ܵ��������CuSO4��Һ��������״���µ�O2________��
��C�� D���Ƣ�K=c(CH3OH)/c(CO)��c2(H2) �� �ڡ�H��0����250��
�� CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=��725.76 kJ / mol
�� ����CH3OH -6e��+8OH��=CO32��+6H2O �� ������״���µ�O216.8��
�������������A. CH3OH���������CO�Ƿ�Ӧ����κ�ʱ�̶���������CH3OH������������CO��������ȣ���˲�����Ϊ�ж�ƽ��ı�־������B. ���ڷ�Ӧ��������̶����ܱ������н��У���Ӧǰ����ѭ�����غ㶨�ɣ����������۷�Ӧ�Ƿ�ﵽƽ�⣬���������ܶȶ����䡣��˲�����Ϊ�ж�ƽ��ı�־������C. ���ڸ÷�Ӧ�Ǹ���Ӧǰ������������ȵĿ��淴Ӧ����δ�ﵽƽ�⣬��������ʵ�����Ҫ�����仯����������ܶ�ҲҪ�����仯���������������ƽ����������ҲҪ�����仯����˻����������ƽ�������������䡣������Ϊ�жϷ�Ӧ�ﵽƽ��ı�־����ȷ��D. ����Ӧ�ﵽƽ�⣬��Ӧ�������CH3OH��CO��H2���κ�һ����ֵ�����Ũ�������Ũ����ȣ���Ũ�ȶ����ٷ����仯����˿�����Ϊ�жϷ�Ӧ�ﵽƽ��ı�־����ȷ���� �ٻ�ѧƽ�ⳣ���ǿ��ܷ�Ӧ�ﵽƽ��״̬ʱ��������Ũ����ָ���ij˻������Ӧ��Ũ����ָ���ij˻��ıȡ�����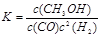 �����ɱ������ݿ�֪�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ�������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����H��0����CO(g)+2H2(g)
�����ɱ������ݿ�֪�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ�������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����H��0����CO(g)+2H2(g) CH3OH(g)�ڷ�Ӧ��ʼʱc(CO)=1mol/L��c(H2)=3mol/L��c(CH3OH)=0mol/L������Ӧ�ﵽƽ��ʱ��C(CO)=0.2mol/L,���Ը��ݷ���ʽ�и������ʵĹ�ϵ��֪c(H2)=1.4mol/L��c(CH3OH)= 0.8mol/L��ѧƽ�ⳣ��
CH3OH(g)�ڷ�Ӧ��ʼʱc(CO)=1mol/L��c(H2)=3mol/L��c(CH3OH)=0mol/L������Ӧ�ﵽƽ��ʱ��C(CO)=0.2mol/L,���Ը��ݷ���ʽ�и������ʵĹ�ϵ��֪c(H2)=1.4mol/L��c(CH3OH)= 0.8mol/L��ѧƽ�ⳣ��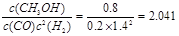 ���Է�Ӧ�¶�Ϊ250�档��3��ȼ������1mol��������ȫȼ�ղ����ȶ���������ʱ�ų���������������Ŀ�ṩ�����ݿ�֪����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=��725.76 kJ / mol����4����ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ������ͨ�������ĵ缫Ϊ���������ڵ����Ϊ���ԣ������ڸ����ĵ缫��ӦʽΪCH3OH -6e��+8OH��=CO32��+6H2O��n(CH3OH)=16g��32g/mol=0.5mol.����n(e-)=0.5mol��6=3mol.���ݵ����غ�ɵ�n(O2)=3mol��4=0.75mol,V(O2)= 0.75mol��22.4L/mol=16.8L��
���Է�Ӧ�¶�Ϊ250�档��3��ȼ������1mol��������ȫȼ�ղ����ȶ���������ʱ�ų���������������Ŀ�ṩ�����ݿ�֪����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=��725.76 kJ / mol����4����ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ������ͨ�������ĵ缫Ϊ���������ڵ����Ϊ���ԣ������ڸ����ĵ缫��ӦʽΪCH3OH -6e��+8OH��=CO32��+6H2O��n(CH3OH)=16g��32g/mol=0.5mol.����n(e-)=0.5mol��6=3mol.���ݵ����غ�ɵ�n(O2)=3mol��4=0.75mol,V(O2)= 0.75mol��22.4L/mol=16.8L��
���㣺���黯ѧƽ��״̬���жϡ���ѧƽ�ⳣ���ı��P���㡢ȼ�ϵ�صĵ缫ʽ������Ӧ�ļ����֪ʶ��

̼�����ڹ�ҵ���ж�����;�����罹̿��������ȡˮú����ұ������������̿�ɴ���������Ⱦ��NO��
һ�������£���2 L�ܱ������м���NO�ͻ���̿�������ʣ���Ӧ��������A��B�����¶���T1��ʱ����ø�����ƽ��ʱ���ʵ������±���
| | ����̿ (mol) | NO (mol) | A (mol) | B (mol) |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| ƽ�� | 2.000 | 0.040 | 0.030 | 0.030 |
��1����T1��ʱ���ﵽƽ���ʱ2���ӣ���NO��ƽ����Ӧ����Ϊ mol��(L��min)��������̿����0.015molʱ����Ӧ��ʱ�� ������ڡ�����С�ڡ����ڡ���1���ӡ�
��2����T1���·�Ӧ�ﵽƽ������д�ʩ���ܸı�NO��ת���ʵ��� ��
a���������̿���� b������ѹǿ c�������¶� d����ȥ����B
��3������ϱ����ݣ��÷�Ӧ��ƽ�ⳣ������ʽΪ ����������A��B����Ӧ�Ļ�ѧʽ��ʾ����T1��ʱ��ƽ�ⳣ��ΪK1��T2��ʱ��ƽ�ⳣ��ΪK2����K1>K2���ܷ��жϸ÷�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ��˵���� ��
��15�֣�ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4 + 5H2C2O4 + 3H2SO4�� K2SO4 + 2MnSO4 + 10CO2�� + 8H2O
��ʵ�����ݼ���¼��
| ʵ���� | �����£��Թ��������Լ��������� / mL | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
��1�������ϱ��е�ʵ�����ݣ����Եõ��Ľ����� ��
��2������ʵ��1�����ݼ��㣬����KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ����(KMnO4)�� ��
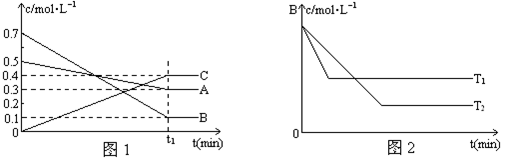
��3����С��ͬѧ���ݾ��������n(Mn2+) ��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+) ��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����

�ٸ�С��ͬѧ����ļ����� ��
�����������С��ͬѧ���ʵ�鷽��������д���пհס�
| ʵ���� | �����£��Թ��������Լ��������� / mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05 mol/L KMnO4��Һ | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
��4����ҵ�Ͽ��õ��K2MnO4Ũ��Һ�ķ�����ȡKMnO4������ʱ�����������ĵ缫��ӦΪ ���ܷ���ʽΪ ��
��1���֣�
Cl2��һ����Ҫ�Ļ���ԭ�ϡ�
��1����ⱥ��NaCl��Һ���Cl2�Ļ�ѧ����ʽ��_______��
��2��Ϊ���ڴ��棬Ҫ������Һ��[ Cl2(g) 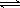 Cl2(l) ]��Ӧ��ȡ�Ĵ�ʩ��_______��д��һ�����ɣ���
Cl2(l) ]��Ӧ��ȡ�Ĵ�ʩ��_______��д��һ�����ɣ���
��3��Һ�ȴ��������е�˵�������£����֣���
| ���� |  |
| ����Ҫ�� | Զ�������ĩ���������ࡢ�������ʣ�������������� |
| й©���� | NaOH��NaHSO3��Һ���� |
| ��װ | ��ƿ |
�� ��Һ��й©�����������ڸ�ƿ�������뱽�ķ�Ӧ���Լӿ죬ԭ���� ��
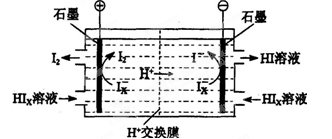
�� ������������ǹ���ԭ��ʾ��ͼ���£�
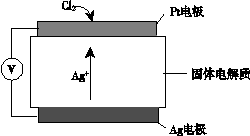
Cl2��Pt�缫�ŵ�ĵ缫��Ӧʽ��_______��
��4��������Ҫ��Һ�Ⱥ�ˮ������1 g������ˮ�������ƣ���0. 4 mg����ˮ����������ظ�ʴ��ƿ��Һ�Ⱥ�ˮ���IJⶨװ������ͼ��ʾ��

����֪��P2O5 + 3H2O = 2H3PO4��Cl2��P2O5����Ӧ����
�� �����ӷ���ʽ˵��cװ�õ�����_______��
�� ���Һ�ȵĺ�ˮ����������ͼ����Ҫ�ⶨ��������_______��
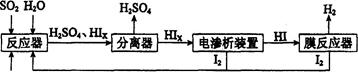
 H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��
H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��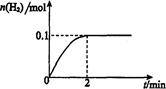

 CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���

 SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��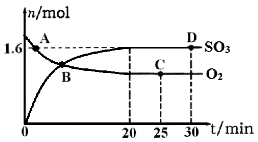
 CH3OH��g����H2O��g��
CH3OH��g����H2O��g�� =-49��0kJ��mol
=-49��0kJ��mol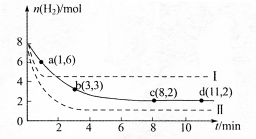
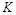 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ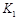 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ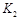 ����
����