题目内容
12.下列说法正确的是( )| A. | 电离能大的元素,不易失电子,易得到电子,表现非金属性 | |
| B. | 电离能大的元素其电负性必然也大 | |
| C. | 电负性最大的非金属元素形成的含氧酸的酸性最强 | |
| D. | 电离能最小的元素形成的氧化物的水化物的碱性最强 |
分析 A.金属性越强,第一电离能越小,非金属性越强,第一电离能越大,而稀有气体为稳定结构,第一电离能较大;
B.元素的第一电离能是指气态原子失去1个电子所需要最低的能量,吸引电子能力越大,电负性越大,电离能大的元素其电负性未必也大;
C.电负性最大的非金属元素为F元素;
D.金属性越强,其最高价氧化物对应的水化合物碱性越强,金属性越强,第一电离能越小.
解答 解:A.电离能大的元素,不易失电子,如He为2电子稳定结构,难失去电子,但He很难得到电子,故A错误;
B.零族元素单质最外层电子都达稳定结构,所以在周期表中0族元素的第一电离能最大,而不是电负性最大,故B错误;
C.F的电负性最大,非金属性最强,F元素没有对应的含氧酸,故C错误;
D.电离能最小的元素,金属性最强,形成的氧化物的水化物的碱性最强,故D正确;
故选D.
点评 本题考查元素的电负性、电离能,为高频考点,侧重电负性、电离能等衡量元素性质的知识点,综合性较强,属于易错题,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.某链状有机物分子中含有m个-CH3、n个-CH2-、a个-CH-,其余为-Cl,则-Cl的数目为( )
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
4. 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.
(1)已知:Ksp[Al(OH)3]=1.3×10-33.实验室利用Al2(SO4)3溶液与氨水反应制备Al(OH)3,若使反应后的溶液中c(Al3+)<1.3×10-6 mol•L-1,应控制溶液pH5.
(2)Al(OH)3可添加到可燃性高聚物中用作阻燃剂,请写出两条其阻燃的原因:Al(OH)3受热分解吸热,抑制聚合物升温;使可燃性高聚物浓度下降;或受热分解放出水汽稀释可燃性气体和氧气的浓度;或分解产生的Al2O3可隔绝氧气;或使塑料等高聚物炭化而不易产生挥发性物质,从而阻止火焰蔓延.
(3)胃舒平药片中含有Al(OH)3和三硅酸镁(Mg2Si3O8•5H2O)等.通过下列实验测定药片中Al(OH)3含量.
已知:测定过程中,EDTA与Al3+、Mg2+、Zn2+均按物质的量1:1反应,发生反应的pH如表所示:
步骤一:准确称取0.7425g Zn(NO3)2•6H2O,用蒸馏水溶解,定容成250mL Zn(NO3)2标准溶液;另配制EDTA溶液250mL,取25.00mL EDTA溶液,调pH为5~6并加入指示剂,用Zn(NO3)2标准溶液滴定至终点,消耗Zn(NO3)2标准溶液50.00mL.
步骤二:取10片(0.45g/片)胃舒平研细,称取2.2500g研细后的粉末,加入足量盐酸和蒸馏水,煮沸、过滤、洗涤沉淀2次,洗涤液与滤液合并,定容成250mL溶液A.
步骤三:移取5.00mL溶液A,调pH=4,准确加入步骤一中配制的EDTA溶液25.00mL,煮沸,充分反应后,调pH为5~6并加入指示剂,以步骤一中配制的Zn(NO3)2标准溶液滴定过量的EDTA至终点,消耗Zn(NO3)2标准溶液20.00mL.
①计算每片胃舒平中Al(OH)3的质量.
②步骤一滴定终点时俯视读数,会使测得胃舒平药片中Al(OH)3的质量偏小(填“偏大”、“偏小”或“不变”).
 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.(1)已知:Ksp[Al(OH)3]=1.3×10-33.实验室利用Al2(SO4)3溶液与氨水反应制备Al(OH)3,若使反应后的溶液中c(Al3+)<1.3×10-6 mol•L-1,应控制溶液pH5.
(2)Al(OH)3可添加到可燃性高聚物中用作阻燃剂,请写出两条其阻燃的原因:Al(OH)3受热分解吸热,抑制聚合物升温;使可燃性高聚物浓度下降;或受热分解放出水汽稀释可燃性气体和氧气的浓度;或分解产生的Al2O3可隔绝氧气;或使塑料等高聚物炭化而不易产生挥发性物质,从而阻止火焰蔓延.
(3)胃舒平药片中含有Al(OH)3和三硅酸镁(Mg2Si3O8•5H2O)等.通过下列实验测定药片中Al(OH)3含量.
已知:测定过程中,EDTA与Al3+、Mg2+、Zn2+均按物质的量1:1反应,发生反应的pH如表所示:
| 金属离子 | Al3+ | Zn2+ | Mg2+ |
| 与EDTA反应的pH | 4 | 5~6 | 9.5~10 |
步骤二:取10片(0.45g/片)胃舒平研细,称取2.2500g研细后的粉末,加入足量盐酸和蒸馏水,煮沸、过滤、洗涤沉淀2次,洗涤液与滤液合并,定容成250mL溶液A.
步骤三:移取5.00mL溶液A,调pH=4,准确加入步骤一中配制的EDTA溶液25.00mL,煮沸,充分反应后,调pH为5~6并加入指示剂,以步骤一中配制的Zn(NO3)2标准溶液滴定过量的EDTA至终点,消耗Zn(NO3)2标准溶液20.00mL.
①计算每片胃舒平中Al(OH)3的质量.
②步骤一滴定终点时俯视读数,会使测得胃舒平药片中Al(OH)3的质量偏小(填“偏大”、“偏小”或“不变”).
7.387K时,在体积为1.0L 的恒容密闭容器中发生反应:2A(g)?B(g)+C(g),该反应的平衡常数 K=4,若起始时向容器中充入0.15mol A、0.15mol B 和0.15mol C,上述平衡( )
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 达到平衡 | D. | 无法判断移动方向 |
17.下列化学式中只能表示一种物质的是( )
| A. | C3H7OH | B. | CH2O | C. | C2H6O | D. | C3H6O2 |
4.下列说法正确的是( )
| A. | 有机反应中常说的卤化、硝化、水化都属于取代反应 | |
| B. | 按系统命名法,有机物 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 分子式为C8H11N的有机物,分子内含苯环和氨基(-NH2)的同分异构体共14种 | |
| D. | 乙烯、氯乙烯、甲苯三种有机物分子内所有原子均在同一平面 |
1.Ⅰ、已知室温下,碳酸的电离常数K1=4.4×10-7,K2=4.7×10-11.NaHCO3水溶液显碱性,在NaHCO3溶液中继续逐渐通入二氧化碳,至溶液中n(HCO3-):n(H2CO3)=4.4时溶液可以达中性.
Ⅱ、工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g) CH3OH(g)△H (CO结构式为C≡O).又知某些化学键的键能(断开 1mol化学键时所需要的最低能量)数值如下表:
则△H=-116kJ•mol-1.
Ⅲ、电化学降解NO3-的原理如图1所示.
①电源 A 极为正极(填“正极”或“负极”),阴极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
②若电解过程中转移了 1mol 电子,则膜左侧电解液的质量减少量为9g.
Ⅳ、已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,10min反应达平衡.反应物浓度随时间变化关系如图2.
①图2中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化.下列不能说明该反应已达到平衡状态的是B.
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
②前 10min内化学反应的平衡常数K(b) 值为$\frac{10}{9}$
③反应 25min 时,若只改变了某一个条件,使曲线发生如图2所示的变化,该条件可能是增大NO2的浓度(用文字表达);其平衡常数 K(d)=K(b)(填“>”、“=”或“<”).
Ⅱ、工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g) CH3OH(g)△H (CO结构式为C≡O).又知某些化学键的键能(断开 1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
Ⅲ、电化学降解NO3-的原理如图1所示.

①电源 A 极为正极(填“正极”或“负极”),阴极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
②若电解过程中转移了 1mol 电子,则膜左侧电解液的质量减少量为9g.
Ⅳ、已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,10min反应达平衡.反应物浓度随时间变化关系如图2.
①图2中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化.下列不能说明该反应已达到平衡状态的是B.
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
②前 10min内化学反应的平衡常数K(b) 值为$\frac{10}{9}$
③反应 25min 时,若只改变了某一个条件,使曲线发生如图2所示的变化,该条件可能是增大NO2的浓度(用文字表达);其平衡常数 K(d)=K(b)(填“>”、“=”或“<”).


 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应. .
.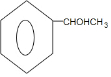 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式)
(填结构简式)