题目内容
6.在下列变化中,①I2的升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水,未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;仅发生共价键破坏的是④;既发生共价键破坏又发生离子键破坏的是⑥.分析 ①碘的升华只是状态发生变化,化学键没有破坏;
②烧碱熔化过程阴阳离子间的化学键被破坏;
③氯化钠溶于水,在水分子的作用下,电离出钠离子与氯离子;
④氯化氢溶于水,在水分子的作用下,电离产生自由移动的氯离子与氢离子;
⑤氧气溶于水,氧气本身的组成和结构未变;
⑥Na2O2溶于水,生成氢氧化钠与氧气,破坏了氧氧非极性共价键和过氧根与钠离子之间的离子键.
解答 解:①碘的升华属于物理变化,只是状态发生变化,没有化学键的破坏;
②烧碱熔化中存在离子键,融化烧碱时,阴阳离子间的化学键被破坏,所以破坏的是离子键;
③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏,所以破坏的是离子键;
④氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被破坏,所以破坏的是共价键;
⑤氧气溶于水,属于物理变化,没有化学键的破坏;
⑥Na2O2溶于水,生成氢氧化钠与氧气,所以所以破坏的是离子键、共价键;
故答案为:①⑤;②③;④;⑥.
点评 本题考查了离子键、共价键的区别,侧重考查学生对概念的辨别能力,离子化合物中可能含有共价键,分子间作用力不属于化学键.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
17.桶烯(Barrelene)结构简式如图所示,则下列有关说法一定正确的是( )
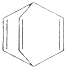

| A. | 0.1mol桶烯完全燃烧需要消耗氧气22.4L | |
| B. | 桶烯在一定条件下能发生加成反应,不能发生加聚反应 | |
| C. | 桶烯二氯取代产物只有三种 | |
| D. | 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 |
1.为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用( )
| A. | KMnO4溶液 | B. | H2O2溶液 | C. | 氯水 | D. | HNO3溶液 |
11.2005年10月5日瑞典皇家科学院在瑞典首都斯德哥尔摩宣布,法国人伊夫•肖万、美国人罗伯特•格拉布和理查德•施罗克,因在烯烃复分解反应研究方面的贡献而荣获2005年度诺贝尔化学奖.在石油化工中,利用烯烃复分解反应可以将丁烯和乙烯转化为丙烯,方程式如下:CH3CH=CHCH3+CH2=CH2$\stackrel{催化剂}{→}$2CH2=CHCH3从反应类型上看,该反应还可看作( )
| A. | 取代反应 | B. | 加成反应 | C. | 消去反应 | D. | 裂解反应 |
18.有8种物质:①甲烷;②苯;③聚乙烯;④异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
15.下列说法正确的是( )
| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |

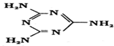 ,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.