题目内容
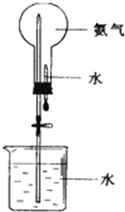 制取氨气并完成喷泉实验(图中夹持装置均已略去)
制取氨气并完成喷泉实验(图中夹持装置均已略去)(1)写出实验室制取氨气的化学反应方程式:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
(2)收集氨气应使用
向下排空气法
向下排空气法
法,要得到干燥的氨气可选用碱石灰
碱石灰
做干燥剂.(3)收集氨气时,验满的方法是
将湿润的红色石蕊试纸置于试管口变蓝
将湿润的红色石蕊试纸置于试管口变蓝
.(4)用如图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操是
打开止水夹,挤出胶头滴管中的水
打开止水夹,挤出胶头滴管中的水
,该实验的原理是氨极易溶解于水,致使烧瓶内外产生气压差
氨极易溶解于水,致使烧瓶内外产生气压差
.(5)假设烧瓶充满标况下的氨气,喷泉实验后溶液充满整个烧瓶,所得溶液物质的量浓度为
0.045mol/L
0.045mol/L
.分析:(1)根据实验室制取氨气的原理,利用盐和碱的复分解反应确定方程式;
(2)根据氨气的性质分析,氨气易溶于水,密度比空气小;可用碱石灰吸收氨气中的水蒸气;
(3)氨气溶于水显碱性;
(4)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(5)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,根据n=
计算氨气的物质的量,再根据c=
计算溶液的物质的量浓度.
(2)根据氨气的性质分析,氨气易溶于水,密度比空气小;可用碱石灰吸收氨气中的水蒸气;
(3)氨气溶于水显碱性;
(4)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(5)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,根据n=
| V |
| Vm |
| n |
| V |
解答:解:(1)氯化铵和氢氧化钙发生复分解反应,生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)由于氨气密度比空气小、易溶于水的性质.所以不能采用排水法收集,只能用向下排空气法的收集;反应过程中会产生水,使氨气中混有水蒸气,可用碱石灰吸收水蒸气,但不能用氯化钙和无水硫酸铜,因为它们均与氨气反应,
故答案为:向下排空气;碱石灰;
(3)氨气溶于水生成一水合氨,溶液显碱性,能是石蕊试纸变蓝色,故答案为:将湿润的红色石蕊试纸置于试管口变蓝;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水;氨极易溶解于水,致使烧瓶内气体压强迅速减小;
(5)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,标况下22.4L氨气的物质的量=
=1mol,故所得溶液的物质的量浓度=
=0.045mol/L,故答案为:0.045mol/L.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)由于氨气密度比空气小、易溶于水的性质.所以不能采用排水法收集,只能用向下排空气法的收集;反应过程中会产生水,使氨气中混有水蒸气,可用碱石灰吸收水蒸气,但不能用氯化钙和无水硫酸铜,因为它们均与氨气反应,
故答案为:向下排空气;碱石灰;
(3)氨气溶于水生成一水合氨,溶液显碱性,能是石蕊试纸变蓝色,故答案为:将湿润的红色石蕊试纸置于试管口变蓝;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水;氨极易溶解于水,致使烧瓶内气体压强迅速减小;
(5)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,标况下22.4L氨气的物质的量=
| 22.4L |
| 22.4L/mol |
| 1mol |
| 22.4L |
点评:本题考查了氨气的制备和性质,物质的量浓度的计算,解答时需理解相关的原理,注意形成喷泉的原理和操作方法是解答的关键,题目难度不大.

练习册系列答案
相关题目
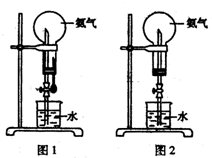 大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验.
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验.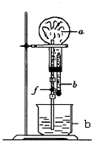 制取氨气并完成喷泉实验:
制取氨气并完成喷泉实验: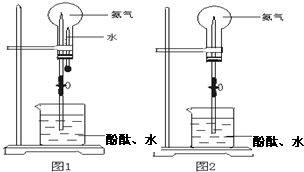
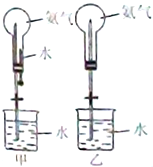 制取氨气并完成喷泉实验(图中夹持装置均已略去)
制取氨气并完成喷泉实验(图中夹持装置均已略去)