题目内容
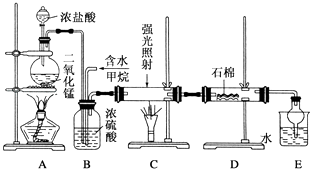
【题目】某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数. 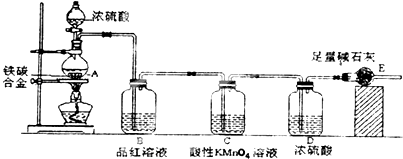
(1)将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中铁的质量分数为(写表达式).
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是 .
【答案】
(1)![]() ×100%
×100%
(2)铁、碳在酸溶液中形成原电池
【解析】解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1.)E增重b g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为 ![]() bg,合金中铁的质量为ag﹣
bg,合金中铁的质量为ag﹣ ![]() bg=(a﹣
bg=(a﹣ ![]() b)g,故铁的质量分数=
b)g,故铁的质量分数= ![]() ×10×%=
×10×%= ![]() ×100%,
×100%,
所以答案是: ![]() ×100%;
×100%;
(2.)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,可能是铁和杂质碳在硫酸溶液中形成原电池反应,铁做负极发生氧化反应,加快反应速率,
所以答案是:铁、碳在酸溶液中形成原电池.

练习册系列答案
相关题目
【题目】下列有关A、B、C、D四种固体样品的性质中,最可能是有机物的是( )
性质 | 熔点 | 水溶性 | 稳定性(高温、加热) | 导电性 |
A | 高 | 溶 | 稳定 | 导电 |
B | 低 | 不溶 | 分解 | 不导电 |
C | 高 | 不溶 | 稳定 | 不导电 |
D | 低 | 溶 | 分解 | 导电 |
A. A B. B C. C D. D