题目内容
【题目】CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
回答下列问题:
(1)已知:H2和CH3OH的燃烧热分别为-285.8kJ·mol-1,-726.51kJ·mol-1;以及H2O(l)=H2O(g) △H=+44kJ·mol-1;则该反应的△H=________________;
(2)该反应的平衡常数表达式为________________;
(3)在350℃时,体积为0.5L的密闭容器中,充入1molCO2和3molH2发生上述反应,测定出CH3OH的体积分数随时间变化的曲线如图所示:

①能判断该反应达到化学平衡状态的依据是__________________;
A.容器内压强不变 B.H2的体积分数不变 C.c(CH3OH)=c(H2O) D.容器内密度不变
②氢气在0~10min的平衡反应速率v(H2)=_________________________;
③在右图中标出400℃时CH3OH的体积分数随时间变化的曲线。
(4)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气。试回答下列问题:

①这种电池放电时,b处通入______________,发生的电极反应方程式是_____________________。
②若电解液中的3molH+通过质子交换膜,则消耗甲醇__________L(标准状况)。
【答案】
(1)CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-86.89 kJmol-1
(2) K=![]()
(3)①AB ② 0.45mol/(L·min) ③ 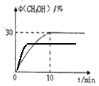
(4)① 空气 O2+4e-+4H+=2H2O ②11.2
【解析】
试题分析:(1)由H2(g)的燃烧热△H为-285.8kJmol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;②CH3OH(l)+
O2(g)=H2O(l)△H=-285.8kJmol-1;②CH3OH(l)+ ![]() O2(g)=CO2(g)+2 H2O(l)△H=-726.51kJmol-1,③H2O(l)=H2O(g) △H=+44kJ·mol-1;由盖斯定律可知,3×①-②+③得CO2(g)+3H2(g)=CH3OH(l)+H2O(g)△H=-86.89 kJmol-1;
O2(g)=CO2(g)+2 H2O(l)△H=-726.51kJmol-1,③H2O(l)=H2O(g) △H=+44kJ·mol-1;由盖斯定律可知,3×①-②+③得CO2(g)+3H2(g)=CH3OH(l)+H2O(g)△H=-86.89 kJmol-1;
(2)该反应的平衡常数表达式K=![]() ;
;
(3)①A.反应体系两边系数不等,反应进行的过程中气体的物质的量总和不断变化,则容器内压强不变,说明气体总物质的量不变,是平衡状态,故A正确;B.反应体积中H2的体积分数不变,反应达到平衡状态,故B正确;C.随着反应的进行c(CH3OH)=c(H2O)始终成立,故不一定是平衡状态,故C错误;D.密度等于质量除去体积,质量和体积始终是定值,则容器内密度不变不一定是平衡状态,故D错误;答案为AB。
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量(mol) 1 3 0 0
变化物质的量(mol) x 3x x x
平衡物质的量(mol) 1-x 3-3x x x
平衡时CH3OH的体积分数为![]() ×100%=30%,解得x=0.75,氢气在0~10min的平衡反应速率v(H2)=
×100%=30%,解得x=0.75,氢气在0~10min的平衡反应速率v(H2)=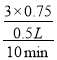 =0.45mol/(L·min);
=0.45mol/(L·min);
③CO2(g)+3H2(g)=CH3OH(l)+H2O(l) △H=-86.89 kJmol-1 是放热反应,升高温度平衡逆向移动,达到新平衡时CH3OH的体积分数减小,但达到平衡需要的时间缩短了,具体如图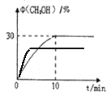 ;
;
(4)①原电池工作时电子由负极经外电路流向正极,H+向正极移动,负极发生氧化反应,正极发生还原反应,由b处通入的为空气,发生的电极反应方程式为O2+4e-+4H+=2H2O;
②若电解液中的3molH+通过质子交换膜,则转移电子的物质的量为3mol,被氧化的甲醇的物质的量![]() =0.5mol,标准状况下体积为22.4L/mol×0.5mol=11.2L。
=0.5mol,标准状况下体积为22.4L/mol×0.5mol=11.2L。

 阅读快车系列答案
阅读快车系列答案【题目】根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是( )
晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
A.AlCl3为离子晶体
B.MgCl2为离子晶体
C.SiCl4是分子晶体
D.单质R可能是原子晶体





