题目内容
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
I.四种制取Cu2O的方法:
(1)火还原法:用炭粉在高温条件下还原CuO。
(2)用葡萄糖[CH2OH(CHOH)4CHO]还原新制的Cu(OH)2,写出该反应的化学方程式:___。
(3)电解法:反应为2Cu +H2O Cu2O+H2↑,则阳极产物是___。
Cu2O+H2↑,则阳极产物是___。
(4)最新研究表明用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。该方法的化学方程式为___ 。
Ⅱ,用制得的Cu2O进行催化分解水的实验。
(1)一定温度下,向2L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:
2H2O(g) 2H2(g)+ O2(g) △H=+484 kJ.mol-1,不同时间内产生O2的量如下表:
2H2(g)+ O2(g) △H=+484 kJ.mol-1,不同时间内产生O2的量如下表:
I.四种制取Cu2O的方法:
(1)火还原法:用炭粉在高温条件下还原CuO。
(2)用葡萄糖[CH2OH(CHOH)4CHO]还原新制的Cu(OH)2,写出该反应的化学方程式:___。
(3)电解法:反应为2Cu +H2O
 Cu2O+H2↑,则阳极产物是___。
Cu2O+H2↑,则阳极产物是___。 (4)最新研究表明用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。该方法的化学方程式为___ 。
Ⅱ,用制得的Cu2O进行催化分解水的实验。
(1)一定温度下,向2L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:
2H2O(g)
 2H2(g)+ O2(g) △H=+484 kJ.mol-1,不同时间内产生O2的量如下表:
2H2(g)+ O2(g) △H=+484 kJ.mol-1,不同时间内产生O2的量如下表: 
计算前20 min的反应速率v(H2O)=___;达到平衡时,至少需要吸收___kJ的光能。
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的速率(v)随时间(t)变化的关系如图所示,下列叙述正确的是___(填序号)。
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的速率(v)随时间(t)变化的关系如图所示,下列叙述正确的是___(填序号)。

A.c、d曲线对应方法制得的Cu2O的催化效率相对较高
B.d曲线对应方法制得的Cu2O作催化剂时,水的转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
B.d曲线对应方法制得的Cu2O作催化剂时,水的转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
I. (2) CH2OH(CHOH)4CHO +2Cu(OH)2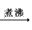 CH2OH(CHOH)4COOH+Cu2O↓+2H2O
CH2OH(CHOH)4COOH+Cu2O↓+2H2O
[或CH2OH(CHOH)4CHO +2Cu(OH)2 + NaOH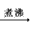 CH2OH ( CHOH)4COONa + Cu2O↓+3H2O]
CH2OH ( CHOH)4COONa + Cu2O↓+3H2O]
(3)Cu2O
(4)4Cu(OH)2 +N2 H4 =2Cu2O+ N2 +6H2O
Ⅱ. (1)5.0×10-5 mol.L-1.min -1 ;0. 968
(2)ACD
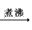 CH2OH(CHOH)4COOH+Cu2O↓+2H2O
CH2OH(CHOH)4COOH+Cu2O↓+2H2O[或CH2OH(CHOH)4CHO +2Cu(OH)2 + NaOH
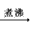 CH2OH ( CHOH)4COONa + Cu2O↓+3H2O]
CH2OH ( CHOH)4COONa + Cu2O↓+3H2O] (3)Cu2O
(4)4Cu(OH)2 +N2 H4 =2Cu2O+ N2 +6H2O
Ⅱ. (1)5.0×10-5 mol.L-1.min -1 ;0. 968
(2)ACD

练习册系列答案
相关题目
科学研究发现纳米级的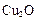 可作为太阳光分解水的催化剂。
可作为太阳光分解水的催化剂。
Ⅰ.四种制取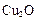 的方法
的方法
(1)火法还原。用炭粉在高温条件下还原CuO;
(2)用葡萄糖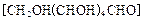 还原新制的
还原新制的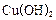 。写出化学方程式 ;
。写出化学方程式 ;
(3)电解法。反应为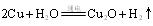 。则阳极产物是 ;
。则阳极产物是 ;
(4)最新实验研究用肼(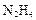 )还原新制
)还原新制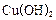 可制备纳米级
可制备纳米级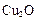 ,同时放出
,同时放出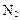 。该制法的化学方程式为 。
。该制法的化学方程式为 。
Ⅱ.用制得的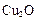 进行催化分解水的实验
进行催化分解水的实验
(1)一定温度下,在2L密闭容器中加入纳米级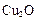 并通入0.10mol水蒸气,发生反应:
并通入0.10mol水蒸气,发生反应: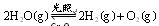 ;△H= +484kJ/mol,不同时段产生
;△H= +484kJ/mol,不同时段产生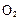 的量见下表:
的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
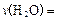 ;达平衡时,至少需要吸收的光能为 kJ。
;达平衡时,至少需要吸收的光能为 kJ。(2)用以上四种方法制得的
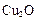 在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。
在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。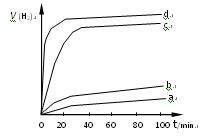
A.c、d方法制得的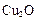 催化效率相对较高 催化效率相对较高 |
B.d方法制得的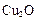 作催化剂时,水的平衡转化率最高 作催化剂时,水的平衡转化率最高 |
C.催化效果与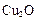 颗粒的粗细、表面活性等有关 颗粒的粗细、表面活性等有关 |
| D.Cu2O催化水分解时,需要适宜的温度 |
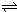 2H2(g)+O2(g)△H=+484kJ?mol-1;测得20min时O2的物质的量为0.0016mol,则前20min的反应速率v(H2O)=
2H2(g)+O2(g)△H=+484kJ?mol-1;测得20min时O2的物质的量为0.0016mol,则前20min的反应速率v(H2O)=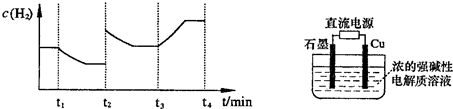

 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
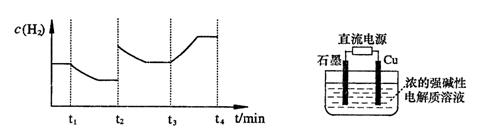
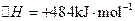 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;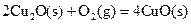 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 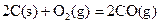 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1