题目内容
【题目】元素周期表是进行化学研究的重要工具,如图是元素周期表的一部分,其中①~⑨代表9种元素。请回答下列问题:
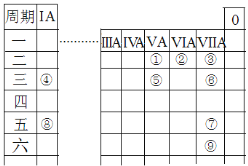
(1)上述元素中最高价氧化物对应的水化物的酸性最强的是___(填物质的化学式)。
(2)上述元素中最稳定的简单氢化物是___(填物质的化学式),请用电子式表示其形成过程:___;②④⑥形成的1:1:1型化合物的电子式为___。
(3)下列推断正确的是___(填选项字母)。
A.⑨的单质可能为白色固体
B.⑧的单质能与水剧烈反应生成氢气
C.①、⑥的简单氢化物之间反应的产物中既含离子键又含极性键
【答案】HClO4 HF ![]()
![]() BC
BC
【解析】
根据元素周期表结构及元素的位置可知,①为N,②为O,③为F,④为Na,⑤为P,⑥为Cl,⑦为I,⑧为Rb,⑨为At,再根据同周期、同主族元素性质的递变规律回答。
根据元素周期表结构及元素的位置可知,①为N,②为O,③为F,④为Na,⑤为P,⑥为Cl,⑦为I,⑧为Rb,⑨为At;
(1)因为F元素无正价,故上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4,故答案为:HClO4;
(2)上述元素中,F元素的非金属性最强,故最稳定的简单氢化物是HF,电子式表示其形成过程:![]() ,②④⑥形成的1:1:1型化合物为NaClO,其电子式为:
,②④⑥形成的1:1:1型化合物为NaClO,其电子式为: ![]() ,故答案为:HF;
,故答案为:HF;![]() ;
;![]() ;
;
(3)A.⑨单质为At,卤素单质的颜色从上到下逐渐加深,故At不可能是白色固体,故A错误;
B.⑧为Rb,碱金属单质与水反应均生成H2,且活泼性从上到下逐渐增强,故Rb能与水剧烈反应生成氢气,故B正确;
C.①为N,⑥为Cl,它们的简单氢化物是NH3和HCl,两者反应生成NH4Cl,NH4Cl既含离子键又含极性键,故C正确。
故答案为:BC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目