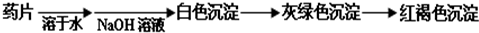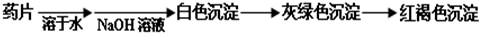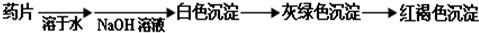题目内容
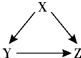 下列几组物质中能按照右边关系图进行转化的一组是(→表示反应一步完成)( )
下列几组物质中能按照右边关系图进行转化的一组是(→表示反应一步完成)( )| 物质 | A | B | C | D |
| X | Fe2O3 | C | CaCO3 | Cu |
| Y | Fe | CO | CaO | CuO |
| Z | FeCl2 | CO2 | Ca(OH)2 | Cu(OH)2 |
B、碳在氧气充足时燃烧生成二氧化碳,在氧气不充足时燃烧生成一氧化碳,生成的一氧化碳可以被氧化为二氧化碳,即C→CO→CO2→C,故B正确;
C、碳酸钙高温能分解生成氧化钙,碳酸钙是不溶性盐,不能直接反应生成氢氧化钙,故C错误;
D、铜可被氧气氧化为氧化铜,铜的化学性质不活泼,不能一步反应生成氢氧化铜,故D错误;
故选B.

A.(物质结构与性质)A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3 倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为_____________,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于_____________,A与C所形成的化合物的熔、沸点明显高于A与C的同主族元素所形成的化合物的熔、沸点,其原因是_____________________________________________________________________。
(2)当n=2时,B原子的结构示意图为_________,B与C形成的晶体属于________晶体。
当n=3时,B与C形成的晶体中,B原子的杂化方式为________________________,该晶体中最小的环共有________个微粒构成,微粒间的作用力是____________________________。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是_____________,A、B、C、D四种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
B.(实验化学 )某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。

(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100 mL气体A进行实验,实验记录如下:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
B中的现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为_____________。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?_____________(填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?_____________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
a | 在烧瓶中加热适量浓硝酸 4HNO3 | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
b | 加热AgNO3固体 2AgNO3 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
c | 加热Cu(NO3)2固体 2Cu(NO3)2 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a.__________,原因是__________________________________________________。
b.__________,原因是__________________________________________________。
c.__________,原因是__________________________________________________。