题目内容
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)="0.3" mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
(6分) (1)V(SO2)= 4.48L (3分)(2)c(H +)=0.84mol/L (3分)
解析试题分析:(1)测得c(Cu2+)="0.3" mol/L
则溶液中硫酸铜的物质的量是0.3mol/L×1L=0.3mol
其中铜离子的质量是0.3mol×64g/mol=19.2g
则原固体混合物中氧元素的质量是20.8g-19.2g=1.6g
物质的量是1.6g÷16g/mol=0.1mol
所以氧化铜的物质的量是0.1mol
质量是8g
则铜的质量是20.8g-8g=12.8g
物质的量是12.8g÷64g/mol=0.2mol
所以根据反应的化学方程式可知
Cu+2H2SO4(浓)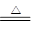 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
生成的SO2是0.2mol
标准状况下是0.2mol×22.4L/mol=4.48L
(2)氧化铜和铜消耗的硫酸的物质的量分别是0.1mol和0.4mol
则剩余硫酸的物质的量是0.05L×18.4mol/L-0.5mol=0.42mol
所以氢离子的物质的量是0.84mol
氢离子的浓度是0.84mol÷1L=0.84mol/l
考点:考查铜和氧化铜混合物与浓硫酸反应的有关计算
点评:该题是中等难度的试题,试题综合性强,贴近高考。试题注重基础,侧重能力的培养和训练。有利于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。该题的关键是利用好守恒法在计算中的应用,常用的守恒法包括质量守恒定律、电子得失守恒、电荷守恒以及原子守恒。
