题目内容
【题目】贵州的矿产资源丰富,在全国占优势地位的有铝、磷、煤、锰、重晶石、黄金、铅锌、锑等众多品种。回答下列问题:
(1)金元素属于铜族元素,原子结构与铜相似,在元素周期表中位于第六周期,基态金原子的外围电子排布图为__________;Cu2+能与多种离子或分子形成稳定性不同的配合物。经X射线衍射测得配合物酞菁铜的晶体结构,其局部结构如图所示:
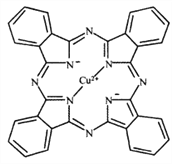
①酞菁铜结构中非金属元素电负性由大到小的顺序为__________;
②酞菁铜结构中N原子的轨道杂化类型为__________。酞菁铜结构中不存在的化学键类型为__________
A.配位键 B.金属键 C.σ键 D.π键
(2)煤通过干馏、气化、液化可获得清洁燃料和多种化工原料,氨是其中之一。NH3的 VSEPR模型为__________。
(3)锰、铁两元素中第三电离能较大的是__________(填元素符号),原因是___________。
(4)碲化锌(ZnTe)具有宽禁带的特性,常用于制作半导体材料,碲化锌晶体有立方和六方两种晶型,其立方晶胞结构如下图所示。
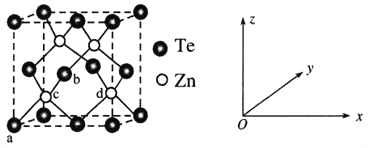
①原子坐标参数表示晶胞内部各原子的相对位置。已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() )。则d的原子坐标参数为__________。
)。则d的原子坐标参数为__________。
②若两个距离最近的Te原子间距离为apm,则晶体密度为__________g/cm3(列式即可)。
【答案】  N>C>H sp2;sp3 B 四面体 Mn Mn失去的是半充满的3d5电子,而Fe失去的是3d6电子,所以Mn的第三电离能大
N>C>H sp2;sp3 B 四面体 Mn Mn失去的是半充满的3d5电子,而Fe失去的是3d6电子,所以Mn的第三电离能大 ![]()
![]() 或
或![]()
【解析】(1)金元素属于铜族元素,原子结构与铜相似,在元素周期表中位于第六周期。铜是3d104s1,基态金原子应是5d106s1,故其的外围电子排布图为 ;
;
①酞菁铜结构中非金属元素有C、N、H,电负性由大到小的顺序为N>C>H;
②酞菁铜结构中N原子有两种,一种有3对价层电子对,另一种有4对价层电子对,故其轨道杂化类型为sp2;sp3;酞菁铜结构中有配位键、σ键、π键,没有金属键,故选B;
(2)NH3的 VSEPR模型为四面体;
(3)锰、铁两元素中第三电离能是在Mn2+、Fe2+的基础上再失一个电子消耗的能量,Mn2+的外围电子排布式为:3d5,Fe2+的外围电子排布式为:3d6,Mn2+为半充满,更稳定故其第三电离能较大;
(4)①碲化锌立方晶胞结构和金刚石的晶胞类似,d原子均位于体对角线的四分之一处,c的原子坐标参数为 (![]() ,
,![]() ,
,![]() ),在晶胞左下角,d则在右下角位置,故其坐标为
),在晶胞左下角,d则在右下角位置,故其坐标为![]() ;
;
②两个距离最近的Te原子间距离为晶胞面对角线的一半,是apm,故晶胞边长为:![]() pm,一个晶胞中有4个Te,4个Zn,故晶胞密度为:
pm,一个晶胞中有4个Te,4个Zn,故晶胞密度为:![]() g/cm3。
g/cm3。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案