题目内容
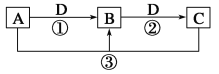
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。

已知:2Fe2++Br2=2Fe3++2Br-
2Fe3++2I-=2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为 。
(2)C→D代表 离子浓度的变化。
(3)当通入1mol Cl2时,溶液中已发生的离子反应可表示为: 。
(4)原溶液中:n(Fe2+):n(I-):n(Br-)= 。
(5)通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
【答案】(1)I->Fe2+>Br-
(2)Fe2+
(3)Cl2+2I-=2Cl-+I2
(4)2:1:3
(5)2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
【解析】
试题分析:(1)反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-。故答案为:I->Fe2+>Br-;
(2)依据(1)的分析可知,离子被氧化的顺序为I-、Fe2+、Br-,所以C→D代表Fe2+的浓度变化。故答案为:Fe2+;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,溶液中已经发生的离子反应可表示为:Cl2+2I-=2Cl-+I2。故答案为:Cl2+2I-=2Cl-+I2;
(4)依据坐标图可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3。故答案为:2:1:3;
(5)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的______________族。
(2)用电子式表示HCl的形成过程______________。
(3)依据上表,可以推测出:随着原子序数的递增,___________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________。